уборка помещений любой сложности!
Полученный из перекиси водорода кислород нельзя определять по запаху
Верны ли следующие суждения о правилах безопасной работы в химической лаборатории? А. Полученный из пероксида водорода кислород нельзя определить по запаху. Б. Водород, полученный в результате взаимо
Задание № 11301
Верны ли следующие суждения о правилах безопасной работы в химической лаборатории?
А. Полученный из пероксида водорода кислород нельзя определить по запаху.
Б. Водород, полученный в результате взаимодействия цинка с соляной кислотой, при поджигании не надо проверять на чистоту.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Показать ответ
Комментарий:Кислород нельзя определить по запаху, потому что он не пахнет;
Водород надо проверять на чистоту перед поджиганием, так как он способен образовывать взрывоопасные смеси.
Ответ: 1Улучши свой результат с курсами ЕГЭ/ОГЭ/ВПР на egevpare.ru
Предложи свой вариант решения в комментариях 👇🏻
Вариант 5
Задание №1.
На приведенном рисунке
изображена модель атома
1. Бериллия
2. Гелия
3. Натрия
4. Лития
Объяснение: у атома элемента, схема которого приведена на рисунке, два электронных слоя, на первом слое два электрона и на втором тоже 2. Значит это элемент с порядковым номером 4, а это - бериллий. Правильный ответ - 1.
Задание №2.
Основным является высший оксид каждого из химических элементов, имеющих в периодической системе Д.И. Менделеева порядковые номера:
1. 11, 7, 16
2. 19, 15, 17
3. 12, 3, 20
4. 6, 14, 16
Объяснение: основными оксидами являются оксиды щелочных и щелочноземельных металлов. Свойства основных оксидов можно посмотреть здесь. Из перечисленных выбираем магний, литий и кальций. Правильный ответ - 3.
Задание №3.
Ковалентной неполярной связью образовано каждое из веществ, формулы которых:
1. Br2, h3, O2
2. O2, S8, h3S
3. O2, h3, h3O
4. CO, Ch5, h3
Объяснение: ковалентная неполярная связь образуется между атомами одного и того же элемента, поэтому выбираем бром, водород и кислород. Правильный ответ - 1.
Задание №4.
Отрицательная степень окисления химических элементов численно равна:
1. Номеру группы в периодической системе
2. Числу электронов, недостающих до завершения внешнего электронного слоя
3. Числу электронных слоев в атоме
4. Номеру периода, в котором находится элемент в периодической системе
Объяснение: отрицательная степень окисления показывает сколько электронов не хватает атому до заполнения электронного слоя, так как отрицательная степень окисления - это наличие электронов (ситуация, при которой атом электроны забрал). Правильный ответ - 2.
Задание №5.
К сложным веществам относится:
1. Красный фосфор
2. Алмаз
3. Воздух
4. Угарный газ
Объяснение: сложные вещества состоят из атомов двух или более элементов. Красный фосфор и алмаз - простые вещества, воздух - смесь газов, угарный газ - сложное вещество - СО. Правильный ответ - 4.
Задание №6.
Реакции замещения соответствует уравнение:
1. 2NaOH + CO2 = Na2CO3 + h3O
2. NaCl + AgNO3 = NaNO3 + AgCl
3. CuO + h3SO4 = CuSO4 + h3O
4. Fe2O3 + 3C = 2Fe + 3CO
Объяснение: реакция замещения - реакция при которой одни атомы или функциональные группы меняются на другие. Из приведенных, реакцией замещения является последняя, в ней углерод замещает железо в оксиде. Правильный ответ - 4.
Задание №7.
Верны ли следующие суждения об электролитической диссоциации солей?
А. Все соли при диссоциации образуют катионы металлов, катионы водорода и анионы кислотных остатков.
Б. Соли в процессе диссоциации образуют катионы металлов и анионы кислотных остатков.
1. Верно только А
2. Верно только Б
3. Верны оба суждения
4. Оба суждения неверны
Объяснение: первое утверждение неверно, так как катионы металлов, катионы водорода и анионы кислотных остатков при диссоциации дают только кислые соли. А второе утверждение верно. Правильный ответ - 2.
Задание №8.
Осадок белого цвета, нерастворимый в кислотах и щелочах, образуется в результате реакции, сокращенное ионное уравнение которой:
1. Zn²+ + 2OH‾ = Zn(OH)2
2. Fe²+ + 2OH‾ = Fe(OH)2
3. Ca²+ + CO3²‾ = CaCO3
4. Ba²+ + SO4²‾ = BaSO4
Объяснение: карбонат кальция растворяется в кислотах, гидроксиды образуют комплексы в щелочах. Сульфат бария нерастворим ни в кислотах ни в щелочах. Правильный ответ - 4.
Задание №9.
Цинк вытесняет металл из раствора:
1. Нитрата кальция
2. Нитрата калия
3. Нитрата меди (II)
4. Сульфата алюминия
Объяснение: цинк может вытеснить только менее активный металл. Среди кальция, калия, меди и алюминия слабее цинка только медь (см. ряд напряжений металлов). Правильный ответ - 3.
Задание №10.
Верны ли следующие суждения об оксидах?
А. При взаимодействии кислотных оксидов с основными образуются соли.
Б. Оксид серы (VI) реагирует как с гидроксидом натрия, так и с оксидом калия.
1. Верно только А
2. Верно только Б
3. Верны оба суждения
4. Оба суждения неверны
Объяснение: оба суждения верны, такой вывод можно сделать, вспомнив химические свойства оксидов. Правильный ответ - 3.
Задание №11.
Раствор серной кислоты не взаимодействует с веществом, формула которого:
1. CuO
2. Cu
3. Ca(OH)2
4. Ba(NO3)2
Объяснение: раствор серной кислоты, как и все кислоты (кроме азотной) не реагирует с металлами, стоящими в ряду напряжений металлов после водорода. Таким металлом является медь. Правильный ответ - 2.
Задание №12.
Химическая реакция возможна между солями:
1. Na2CO3 и KCl
2. Al2(SO4)3 и NaNO3
3. AlCl3 и K2SO4
4. AgNO3 и Na3PO4
Объяснение: реакция обмена возможна только при образовании газа или осадка. Осадком является фосфат серебра, образующийся в последней реакции. Запишем ее.
3AgNO3 + Na3PO4 = 3NaNO3 + Ag3PO4↓
Правильный ответ - 4.
Задание №13.
Верны ли следующие суждения об обращении с газами в процессе лабораторных опытов?
А. Полученный из перекиси водорода кислород нельзя определять по запаху.
Б. Водород, полученный в аппарате Киппа, не надо проверять на чистоту.
1. Верно только А
2. Верно только Б
3. Верны оба суждения
4. Оба суждения неверны
Объяснение: кислород (как и все остальные газы) в лаборатории нельзя проверить по запаху, так как кислород запаха не имеет. Водород всегда нужно проверять на чистоту вне зависимости от способа получения. Правильный ответ - 4.
Задание №14.
В химической реакции, уравнение которой
2KI + SO3 = K2SO3 + I2
окислителем является
1. I‾ в иодиде калия
2. О²‾ в оксиде серы (VI)
3. К+1 в иодиде калия
4. S+6 в оксиде серы (VI)
Объяснение: в данной окислительно-восстановительной реакции йод и сера меняют степень окисления. Запишем баланс.
S(+6) +2e → S(+4) - окислитель
2I(-1) -2e → I2(0) - восстановитель
То есть, окислителем является сера в оксиде серы (VI).
Правильный ответ - 4.
Задание №15.
Какое распределение массовых долей элементов соответствует количественному составу гидроксида калия?
1. 28,5,1,5, 70
2. 28,5, 3,5 67
3. 43, 3, 54
4. 42, 5, 53
Объяснение:
Ar(K) = 39 г/моль
Ar(H) = 1 г/моль
Ar(O) = 16 г/моль
Mr(KOH) = 56 г/моль
ω(К) = 39/56 х 100% = 70%
ω(Н) = 1/56 х 100% = 1,8%
ω(О) = 16/56 х 100% = 28,2%
Правильный ответ - 1.
Задание №16.
Общим для хлора и брома является
1. Наличие на внешнем электронном слое одинакового числа электронов
2. Наличие четырех электронных слоев в атомах
3. Одинаковое физическое состояние образованных ими простых веществ
4. Образование ими высших оксидов с общей формулой Э2О7
5. То, что они являются более сильными окислителями, чем фтор
Объяснение: и хлор и бром находятся в седьмой группе и называются галогенами, то есть на внешнем электронном слое оба элемента имеют одинаковое количество электронов - 7. В простом состоянии хлор является газом, бром - жидкостью. Оба образуют высшие оксиды с формулой Э2О7. Фтор является более сильным окислителем, чем оба эти галогена. Правильный ответ - 1.
Задание №17.
Для стеариновой кислоты характерны следующие утверждения
1. Хорошо растворяется в воде
2. Относится к кислородсодержащим органическим соединениям
3. Изменяет окраску лакмуса
4. Не содержит функциональных групп
5. Взаимодействует с кислородом
Объяснение: формула стеариновой кислоты - С8Н36О2, относится к карбоновым кислотам, то есть имеет функциональную группу - карбоксильную. Нерастворима в воде. Вступает в реакцию горения с кислородом (реакция идет до углекислого газа и воды). Правильный ответ - 25.
Задание №18.
Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти свойства.
Вещества
А. K2CO3(р-р) и Na2SiO3(р-р)
Б. Na2CO3(тв) и CaCO3(тв)
В. K2SO4(р-р) и KOH(р-р)
Реактив
1. CuCl2(р-р)
2. HNO3(р-р)
3. MgO
4. h3O
Объяснение: карбонат калия и силикат натрия можно различить при помощи азотной кислоты, в первой реакции выделяется углекислый газ. Твердые карбонат натрия и карбонат кальция различим водой, потому что карбонат натрия растворим в воде, а карбонат кальция - нерастворим (белый осадок). Сульфат калия и гидроксид калия отличить друг от друга можно при помощи раствора хлорида меди, так как образующийся во второй реакции гидроксид меди синего цвета и нерастворим в воде. Правильный ответ - 241.
Задание №19.
Установите соответствие между названием вещества и реагентами, с которыми это вещество может взаимодействовать.
Название вещества
А. Оксид углерода (II)
Б. Оксид углерода (IV)
В. Карбонат натрия
Реагенты
1. Ba(OH)2(р-р), Mg
2. CO2(р-р), HCl(р-р)
3. Fe2O3, O2
4. h3O, SO2
Объяснение: оксид углерода (II) реагирует с оксидом железа и кислородом. Магний горит в углекислом газе: 2Мg + CO2 = C + 2MgO и еще диоксид углерода реагирует с гидроксидом бария. CO2 + Ba(OH)2 = BaCO3 + h3O
Карбонат натрия вступает в реакцию с углекислым газом и соляной кислотой.
Правильный ответ - 312.
Задание №20.
Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой
h3S + HClO3 → S + HCl + h3O
Определите окислитель и восстановитель.
Объяснение: сера и хлор меняют степень окисления в данной окислительно-восстановительной реакции. Запишем баланс.
S(-2) -2e → S(0) | 3 - восстановитель
Cl(+5) +6e → Cl(-1) | 1 - окислитель
Расставляем коэффициенты.
3h3S + HClO3 → 3S + HCl + 3h3O
Задание №21.
Определите объем (н.у.) оксида углерода (IV), образующегося при растворении 110 г известняка, содержащего 92% карбоната кальция, в избытке соляной кислоты.
Объяснение: запишем уравнение реакции.
CaCO3 + 2HCl = CaCl2 + h3O + CO2↑
Найдем массу чистого известняка.
m(СaCO3) = 110 x 0,92 = 101,2 г
Находим количество вещества карбоната кальция.
n(CaCO3) = 101,2/100 = 1 моль
Количество вещества карбоната кальция равно количеству вещества углекислого газа.
n(CaCO3) = n(CO2) = 1 моль
Найдем объем углекислого газа.
V(CO2) = 1 x 22,4 = 22,4 л
Ответ: объем углекислого газа равен 22,4 л.
Задание №22.
Даны вещества: Al, I2, NaI, NaOH, HNO3. Используя воду и необходимые вещества только из этого списка, получите в две стадии гидроксид алюминия. Опишите признаки проведения реакций. Для реакции ионного обмена напишите сокращенное ионное уравнение реакции.
Объяснение: алюминий реагирует с йодом: 2Al + 3I2 → 2AlI3
Затем йодид алюминия реагирует с гидроксидом натрия, при этом образуется нерастворимый гидроксид алюминия: AlI3 + 3NaOH → 3NaI + Al(OH)3↓
Запишем сокращенное ионное уравнение.
Al³+ + OH‾ → Al(OH)3↓
| № | Ответ | Правильный ответ | Первичный балл |
|---|---|---|---|
| 1 | 3 | 3 | 1 |
Химическому элементу, в атоме которого распределение электронов по слоям 2е, 8е, 7е, соответствует символ этого элемента, формула высшего оксида и водородного соединения: 1) Сl,Сl2O,НСl 2) С, СO2, СН4 3) Сl,Сl2O7,НСl 4) N, N2O5, NH3 | |||
Общее число электронов равно порядковому номеру элемента. e- = 17. Это хлор. | |||
| 2 | 1 | 1 | 1 |
Амфотерным является высший оксид каждого из , имеющих в порядковые номера: 1) 4,13, 30 2) 6, 11, 16, 3) 19,12, 3 4) 6, 14, 17 | |||
BeO, Al2O3, ZnO — амфотерные оксиды. | |||
| 3 | 2 | 2 | 1 |
Ковалентной неполярной связью образовано каждое из веществ в группе: 1) СO2, SiCl4, НВr 2) H2, O2, S8 3) Fe2O3, CaS, К2O 4) НСl, NaCl, PH3 | |||
Ионная связь образуется между атомами металлов и неметаллов. Ковалентная полярная связь образуется между атомами разных элементов-неметаллов. Ковалентная неполярная связь образуется между атомами одного и того же элемента-неметалла. Металлическая связь присуща металлам. H, O, S — неметаллы. | |||
| 4 | 2 | 2 | 1 |
Максимально возможную степень окисления атом серы проявляет в соединении 1) H2S 2) K2SO3 3) FeS2 4) Li2S | |||
Из предложенных вариантов наибольшая степень окисления серы +4 (K2SO3). | |||
| 5 | 4 | 4 | 1 |
Сложным является каждое из двух веществ: 1) вода и хлор 2) вода и водород 3) водород и кварц 4) бензол и вода | |||
Сложные вещества — вещества, состоящие из 2 и более элементов | |||
| 6 | 2 | 2 | 1 |
Признаком химической реакции между растворами сульфата меди(II) и гидроксида калия является: 1) выделение газа 2) выпадение осадка 3) появление запаха 4) поглощение теплоты | |||
CuSO4+2KOH=K2SO4+Cu(OH)2↓ | |||
| 7 | 2 | 2 | 1 |
Сульфит-ионы образуются при электролитической диссоциации 1) MgSO4 2) K2SO3 3) SrSO3 4) Li2S | |||
Сульфит-анионы SO32- образуются только при диссоциации растворимых солей. | |||
| 8 | 3 | 3 | 1 |
Краткое ионное уравнение Н+ + ОН = Н2O отвечает взаимодействию веществ: 1) Н2СO3 и КOН 2) Н3РO4 и Fe(OH)2 3) НСl и КОН 4) НСl и Fe(OH)3 | |||
Практическая работа №4 7 класс. Получение кислорода из пероксида водорода и доказательство его наличия.
Практическая работа №4 7 класс.
Получение кислорода из пероксида водорода и доказательство его наличия.
Цель: 1) познакомиться со способом получения кислорода в лаборатории и его химическим свойством - поддерживать горение;
2) научиться собирать газ в сосуд вытеснением воздуха;
3) совершенствовать умение работать с простейшими приборами.
С техникой безопасности знаком (а)________________________________
План:
1.Налейте в стакан по 8—15 мл раствора пероксида водорода.
2.Добавьте в стакан (на кончике шпателя) оксид марганца (IV). Что наблюдаете?
3. Проверяем наличие кислорода тлеющей лучинкой.
4.Лучинку не макните в пероксид водорода.
5.Напишите уравнение реакции.
2 H2O2 = 2 H2O + O2
Пошла бурная реакция между пероксидом водорода и оксидом марганца (IV).
Тлеющая лучинка загорелась ярким пламенем.
Второй способ получения кислорода.
Получение кислорода из перманганата калия(марганцовки) и гидроперита
Получение кислорода из... — Youtube.com
youtube.com/watch?v=-kem8rOavEo
В основание пробирки, в которой находится перманганат калия поместить комочек ваты и закрыть пробирку газоотводной трубкой.
Закрепить пробирку держателем. Опустить конец газоотводной трубки в пустую пробирку.
Нагреть пробирку с перманганатом калия, соблюдая правила нагревания.
Соберите кислород в пробирку способом вытеснения воздуха. Проверьте его наличие с помощью тлеющей лучинки. Прекратите нагревание.
оформите отчет о работе: а) зарисуйте прибор для сбора кислорода, сделайте соответствующие подписи; б) заполните таблицу, дописав предложения и закончив уравнения реакций.
KMnO4 K2MnO4 + … + …
2. Нагревание пробирки с перманганатом калия и собирание кислорода методом вытеснения воздуха
В пробирке происходит…
Пробирку для сбора кислорода следует держать … дном, потому что…
3. Доказательство наличия кислорода в пробирке с помощью тлеющей лучинки
Тлеющая лучинка…
Кислород поддерживает …
С + О2 =
ВЫВОД. Один из способов получения кислорода в лаборатории – разложение КMnO4. Кислород – газ без цвета и запаха, тяжелее воздуха в 1,103 раза (Mr(O2) = 32, Mr(возд.) = 29, из чего следует 32/29 1,103), малорастворим в воде. Вступает в реакции с простыми веществами, образуя оксиды. Приведите рабочее место в порядок. Сдайте тетради на проверку.
Подумайте и ответьте:
Кислород в лаборатории получают при нагревании перманганата калия. Полученный газ можно собрать путем вытеснения воздуха, используя прибор;
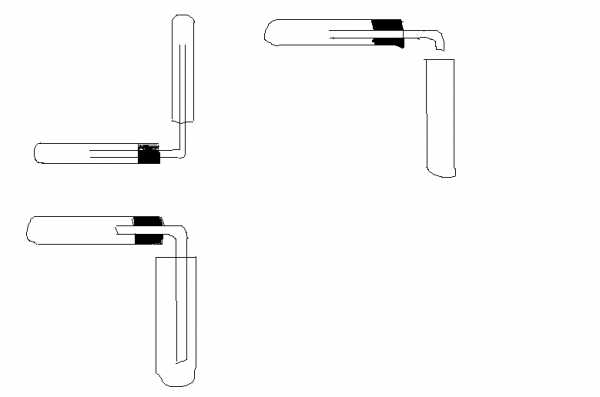
Какую посуду надо использовать при работе?
А) чистую Б) грязную В) с трещинами Г) какая есть, ту и использовать
Пробирку нагревают
А) в верхней части пламени Б) в нижней части пламени В) не имеет значения
Спиртовку тушат
А) задувая огонь Б) колпачком В) руками
Почему нельзя пользоваться грязной посудой?
А) неприятно брать в руки Б) можно получить неточный результат
Получение кислорода простыми способами - Вода и воздух - самое дешевое сырье - Практическая химия
26 июля 2007
Укрепим пробирку из тугоплавкого стекла на штативе и внесем в нее 5 г порошкообразной селитры (нитрата калия КNО3 или нитрата натрия NaNO3). Поставим под пробирку чашку из огнеупорного материала, наполненную песком, так как при этом опыте стекло часто плавится и вытекает горячая масса. Поэтому и горелку при нагревании будем держать сбоку. Когда мы сильно нагреем селитру, она расплавится и из нее выделится кислород (обнаружим это с помощью тлеющей лучины — она воспламенится в пробирке). При этом нитрат калия перейдет в нитрит KNO2. Бросим затем тигельными щипцами или пинцетом кусок черенковой серы в расплав (никогда не держать лицо над пробиркой).
Сера воспламенится и сгорит с выделением большого количества тепла. Опыт следует проводить при открытых окнах (из-за получающихся окислов серы). Полученный нитрит натрия сохраним для последующих опытов.
Процесс протекает следующим образом (через нагревание):
2KNO3 → 2KNO2 + O2
Можно получить кислород и другими методами.
Перманганат калия КMnO4 (калийная соль марганцевой кислоты) отдает при нагревании кислород и превращается при этом в оксид марганца (IV):
4KMnO4 → 4Mn2 + 2K2O + 3O2
или 4KMnO4 → MnO2 + K2MnO4 + O2
Из 10 г перманганата калия можно получить примерно литр кислорода, значит двух граммов достаточно, чтобы наполнить кислородом пять пробирок нормальной величины. Перманганат калия можно приобрести в любой аптеке, если он отсутствует в домашней аптечке.
Некоторое количество перманганата калия нагреем в тугоплавкой пробирке и уловим в пробирки выделяющийся лислород с помощью пневматической ванны. Кристаллы, растрескиваясь, разрушаются, и, зачастую, некоторое количество пылеобразного перманганата увлекается вместе с газом. Вода в пневматической ванне и отводной трубке в этом случае окрасится в красный цвет. После окончания опыта очистим ванну и трубку раствором тиосульфата (гипосульфита) натрия — фотофиксажа, который немного подкислим разбавленной соляной кислотой.
В больших количествах кислород можно также получить из пероксида (перекиси) водорода Н2О2. Купим в аптеке трехпроцентный раствор — дезинфицирующее средство или препарат для обработки ран. Пероксид водорода мало устойчив. Уже при стоянии на воздухе он разлагается на кислород и воду:
2Н2О2 → 2Н2О + О2
Разложение можно существенно ускорить, если добавить к пероксиду немного диоксида марганца МnО2 (пиролюзита), активного угля, металлического порошка, крови (свернувшейся или свежей), слюны. Эти вещества действуют как катализаторы.
Мы можем в этом убедиться, если в маленькую пробирку поместим примерно 1 мл пероксида водорода с одним из названных веществ, а наличие выделяющегося кислорода установим с помощью пробы лучинкой. Если в химическом стакане к 5 мл трехпроцентного раствора пероксида водорода добавить равное количество крови животного, то смесь сильно вспенится, пена застынет и вздуется в результате выделения пузырьков кислорода.
Затем испытаем каталитическое действие 10 %-ного раствора сульфата меди (II) с добавкой гидроксида калия (едкого кали), раствора сульфата железа (П), раствора хлорида железа (III) (с добавкой железного порошка и без него), карбоната натрия, хлорида натрия и органических веществ (молока, сахара, размельченных листьев зеленых растений и т. д.). Теперь мы на опыте убедились, что различные вещества каталитически ускоряют разложение пероксида водорода.
Катализаторы повышают скорость реакции химического процесса и при этом сами не расходуются. В конечном итоге они снижают энергию активации, необходимую для возбуждения реакции. Но существуют и вещества, действующие противоположным образом. Их называют отрицательными катализаторами, антикатализаторами, стабилизаторами или ингибиторами. Например, фосфорная кислота препятствует разложению пероксида водорода. Поэтому продажный раствор пероксида водорода обычно стабилизирован фосфорной или мочевой кислотой.
Катализаторы необходимы для многих химико-технологических процессов. Но и в живой природе во многих процессах участвуют так называемые биокатализаторы (энзимы, ферменты, гормоны). Так как катализаторы не потребляются в реакциях, то они могут действовать уже в малых количествах. Одного грамма сычужного фермента достаточно, чтобы обеспечить свертывание 400—800 кг молочного белка.
Особое значение для работы катализаторов имеет величина их поверхности. Для увеличения поверхности применяют пористые, испещренные трещинами вещества с развитой внутренней поверхностью, напыляют компактные вещества или металлы на так называемые носители. Например, 100 г платинового катализатора на носителе содержит только около 200 мг платины; 1 г компактного никеля имеет поверхность 0,8 см2, а 1 г порошка никеля — 10 мг. Это соответствует отношению 1 : 100000; 1 г активного глинозема обладает поверхностью от 200 до 300 м2, для 1 г активного угля эта величина составляет даже 1000 м2. В некоторых установках катализатора — на несколько миллионов марок. Так, бензиновая контактная печь в Белене высотой 18 м содержит 9—10 тонн катализатора.
Источник: Э.Гроссе, Х.Вайсмантель, «Химия для любознательных»
Получение кислорода - Основы химии на Ида Тен
Содержание статьи
История открытия кислорода
Открытие кислорода ознаменовало новый период в развитии химии. С глубокой древности было известно, что для горения необходим воздух. Процесс горения веществ долгое время оставался непонятным. В эпоху алхимии широкое распространение получила теория флогистона, согласно которой вещества горят благодаря их взаимодействию с огненной материей, то есть с флогистоном, который содержится в пламени. Кислород был получен английским химиком Джозефом Пристли в 70-х годах XVIII века. Химик нагревал красный порошок оксида ртути (II), в итоге вещество разлагалось, с образованием металлической ртути и бесцветного газа:
2HgO t° → 2Hg + O2↑
Оксиды – бинарные соединения, в состав которых входит кислород При внесении тлеющей лучины в сосуд с газом она ярко вспыхивала. Ученый считал, что тлеющая лучина вносит в газ флогистон, и он загорается. Д. Пристли пробовал дышать полученным газом, и был восхищен тем, как легко и свободно им дышится. Тогда ученый и не предполагал, что удовольствие дышать этим газом предоставлено каждому. Результатами своих опытов Д. Пристли поделился с французским химиком Антуаном Лораном Лавуазье.
Имея хорошо оснащенную на то время лабораторию, А. Лавуазье повторил и усовершенствовал опыты Д. Пристли. А. Лавуазье измерил количество газа, выделяющееся при разложении определенной массы оксида ртути. Затем химик нагрел в герметичном сосуде металлическую ртуть до тех пор, пока она не превратилась в оксид ртути (II). Он обнаружил, что количество выделившегося газа в первом опыте равно газу, поглотившемуся во втором опыте. Следовательно, ртуть реагирует с каким-то веществом, содержащимся в воздухе. И это же вещество выделяется при разложении оксида. Лавуазье первым сделал вывод, что флогистон здесь совершенно ни при чем, и горение тлеющей лучины вызывает именно неизвестный газ, который в последствии был назван кислородом. Открытие кислорода ознаменовало крах теории флогистона!
Способы получения и собирания кислорода в лаборатории
Лабораторные способы получения кислорода весьма разнообразны. Существует много веществ, из которых можно получить кислород. Рассмотрим наиболее распространенные способы.
1) Разложение оксида ртути (II)
Одним из способов получения кислорода в лаборатории, является его получение по описанной выше реакции разложения оксида ртути (II). Ввиду высокой токсичности соединений ртути и паров самой ртути, данный способ используется крайне редко.
2) Разложение перманганата калия
Перманганат калия (в быту мы называем его марганцовкой) – кристаллическое вещество темно-фиолетового цвета. При нагревании перманганата калия выделяется кислород. В пробирку насыплем немного порошка перманганата калия и закрепим ее горизонтально в лапке штатива. Недалеко от отверстия пробирки поместим кусочек ваты. Закроем пробирку пробкой, в которую вставлена газоотводная трубка, конец которой опустим в сосуд- приемник. Газоотводная трубка должна доходить до дна сосуда-приемника. Ватка, находящаяся около отверстия пробирки нужна, чтобы предотвратить попадание частиц перманганата калия в сосуд-приемник (при разложении выделяющийся кислород увлекает за собой частички перманганата). Когда прибор собран, начинаем нагревание пробирки. Начинается выделение кислорода.
Уравнение реакции разложения перманганата калия:
2KMnO4 t° → K2MnO4 + MnO2 + O2↑
Как обнаружить присутствие кислорода? Воспользуемся способом Пристли. Подожжем деревянную лучину, дадим ей немного погореть, затем погасим, так, чтобы она едва тлела. Опустим тлеющую лучину в сосуд с кислородом. Лучина ярко вспыхивает! Газоотводная трубка была не случайно опущена до дна сосуда-приемника. Кислород тяжелее воздуха, следовательно, он будет собираться в нижней части приемника, вытесняя из него воздух. Кислород можно собрать и методом вытеснения воды. Для этого газоотводную трубку необходимо опустить в пробирку, заполненную водой, и опущенную в кристаллизатор с водой вниз отверстием. При поступлении кислорода газ вытесняет воду из пробирки.
Разложение пероксида водорода
Пероксид водорода – вещество всем известное. В аптеке оно продается под названием «перекись водорода». Данное название является устаревшим, более правильно использовать термин «пероксид». Химическая формула пероксида водорода Н2О2 Пероксид водорода при хранении медленно разлагается на воду и кислород. Чтобы ускорить процесс разложения можно произвести нагрев или применить катализатор.
Катализатор – вещество, ускоряющее скорость протекания химической реакции
Нальем в колбу пероксид водорода, внесем в жидкость катализатор. Катализатором может служить порошок черного цвета – оксид марганца MnO2. Тотчас смесь начнет вспениваться вследствие выделения большого количества кислорода. Внесем в колбу тлеющую лучину – она ярко вспыхивает. Уравнение реакции разложения пероксида водорода:
2h3O2 MnO2 → 2h3O + O2↑
Обратите внимание: катализатор, ускоряющий протекание реакции, записывается над стрелкой, или знаком «=», потому что он не расходуется в ходе реакции, а только ускоряет ее.
Разложение хлората калия
Хлорат калия – кристаллическое вещество белого цвета. Используется в производстве фейерверков и других различных пиротехнических изделий. Встречается тривиальное название этого вещества – «бертолетова соль». Такое название вещество получило в честь французского химика, впервые синтезировавшего его, – Клода Луи Бертолле. Химическая формула хлората калия KСlO3. При нагревании хлората калия в присутствии катализатора – оксида марганца MnO2, бертолетова соль разлагается по следующей схеме:
2KClO3 t°, MnO2 → 2KCl + 3O2↑.
Разложение нитратов
Нитраты – вещества, содержащие в своем составе ионы NO3⎺. Соединения данного класса используются в качестве минеральных удобрений, входят в состав пиротехнических изделий.
Нитраты – соединения термически нестойкие, и при нагревании разлагаются с выделением кислорода:
Обратите внимание, что все рассмотренные способы получения кислорода схожи. Во всех случаях кислород выделяется при разложении более сложных веществ.
Реакция разложения – реакция, в результате которой сложные вещества разлагаются на более простые В общем виде реакцию разложения можно описать буквенной схемой:
АВ → А + В.
Реакции разложения могут протекать при действии различных факторов. Это может быть нагревание, действие электрического тока, применение катализатора. Существуют реакции, в которых вещества разлагаются самопроизвольно.
Получение кислорода в промышленности
В промышленности кислород получают путем выделения его из воздуха.
Воздух – смесь газов, основные компоненты которой представлены в таблице.
Сущность этого способа заключается в глубоком охлаждении воздуха с превращением его в жидкость, что при нормальном атмосферном давлении может быть достигнуто при температуре около -192°С. Разделение жидкости на кислород и азот осуществляется путем использования разности температур их кипения, а именно: Ткип.
О2 = -183°С
N2 = -196°С (при нормальном атмосферном давлении).
При постепенном испарении жидкости в газообразную фазу в первую очередь будет переходить азот, имеющий более низкую температуру кипения, и, по мере его выделения, жидкость будет обогащаться кислородом. Многократное повторение этого процесса позволяет получить кислород и азот требуемой чистоты. Такой способ разделения жидкостей на составные части называется ректификацией жидкого воздуха.
Итог статьи:
- В лаборатории кислород получают реакциями разложения
- Реакция разложения – реакция, в результате которой сложные вещества разлагаются на более простые
- Кислород можно собрать методом вытеснения воздуха или методом вытеснения воды
- Для обнаружения кислорода используют тлеющую лучину, она ярко вспыхивает в нем
- Катализатор – вещество, ускоряющее химическую реакцию, но не расходующееся в ней
следов крови полностью удаляются новыми продуктами, содержащими активный кислород - ScienceDaily
Группа ученых из Университета Валенсии (УФ) доказала, что следы крови в различных материалах полностью удаляются при промывании их моющими средствами, содержащими активный кислород. кислород. В заключении исследования, опубликованном в последнем номере немецкого журнала Naturwissenschaften, указывается, что эти новые продукты изменяют кровь до такой степени, что это невозможно обнаружить с помощью реагентов, используемых в судебной медицине.
Намерение авторов преступления состоит в том, чтобы не оставлять никаких доказательств, которые могут связать их с преступлением, и часто они убирают место преступления или стирают одежду, чтобы устранить любые признаки, которые могут их выдать. Однако до сих пор полицейским ученым удавалось обнаружить следы крови благодаря таким реагентам, как люминол, фенофталин или тест на человеческий гемоглобин, но новые детергенты делают это все труднее и труднее.
Исследование, проведенное учеными УФ и опубликованное в этом месяце в журнале Naturwissenschaften, показало, что если материалы, окрашенные кровью, промыть продуктами, содержащими активный кислород, тесты на люминол, фенофталин и человеческий гемоглобин дают отрицательный результат.
«Невозможность найти эти следы означает, что очень важные доказательства, такие как профили ДНК, полученные из крови, потеряны», - сказала Ана Кастелло SINC, которая является одним из авторов исследования и преподавателем юридической и судебной медицины в Университете Валенсия.
Исследователь объясняет, что проведенный ими эксперимент включал нанесение нескольких капель крови на три типа материала, а именно на белый хлопок, пару джинсов и полотенце, и давая им высохнуть в течение разного времени, а именно: один, пять, десять, двадцать, тридцать и сорок дней соответственно.Затем образцы были взяты и промыты продуктом, содержащим активный кислород.
«Независимо от типа использованного материала и времени, которое прошло, в каждом отдельном случае, когда были выполнены три теста, присутствие крови не было обнаружено, - отмечает исследователь. Как правило, на месте преступления проводятся ориентировочные тесты на фенофталин. сначала используются (они становятся ярко-розовыми в присутствии насыщенной кислородом воды и крови или других веществ), затем люминол, который высвечивает следы крови в темноте, и, наконец, выполняется анализ человеческого гемоглобина для подтверждения наличия крови.
Хотя исследователи доказали, что результаты были отрицательными в тех образцах, которым был один день, они сочли целесообразным изучить следы возрастом до 40 дней, потому что люминол более эффективен для старых пятен, чем недавние. Однако они не получили положительных результатов, даже делая это.
Неразгаданная тайна
Ученые еще не определили причину, по которой активный кислород вмешивается в методы обнаружения крови, но авторы выдвинули гипотезу.Кастелло предполагает, что «продукты активного кислорода содержат перкарбонат натрия, и когда он растворяется в воде, выделяется значительное количество перекиси водорода (насыщенная кислородом вода), и возможно, что ингибирующий эффект может быть вызван« истощением » гемоглобин в попытке избавиться от перекиси ».
Тем не менее, исследователь приходит к выводу, что промывка материалов продуктами, содержащими активный кислород, не устраняет кровь полностью, потому что остаются коричневые следы, но определенно препятствует обнаружению с помощью текущих тестов ", и это рекомендуется учитывать при использование этих методов в криминалистических исследованиях ».
Преподаватель юридической медицины признает, что это представляет «серьезную» проблему для ученых-полицейских, и настаивает на том, что, если кровь не обнаружена, ДНК не может быть извлечена из жидкости, так что важные доказательства теряются при раскрытии определенных преступлений. Однако Кастельо сообщил SINC, что сейчас они работают над новыми маркерами, чтобы помочь разрешить эту ситуацию.
История Источник:
Материалы предоставлены Plataforma SINC . Примечание. Содержимое можно редактировать по стилю и длине.
.Перекись водорода: применение, побочные эффекты, взаимодействия, изображения, предупреждения и дозировка
Перейти к основному содержанию- Проверьте свои симптомы
- Найти доктора
- Найти стоматолога
- Подключиться к Care
- Найдите самые низкие цены на лекарства
- Здоровье
A-Z - Лекарства и добавки
- Жизнь
Здоровый - Семья и
Беременность - Новости и эксперты
- Войти в систему
- Подписывайся
Почему бы не использовать его
Ожоги - довольно частое явление. Может быть, вы ненадолго прикоснулись к раскаленной плите или утюгу, случайно облили себя кипятком или недостаточно нанесли солнцезащитный крем в солнечный отпуск.
К счастью, большинство легких ожогов можно легко и успешно вылечить в домашних условиях.
Однако, если вы инстинктивно дойдете до перекиси водорода, вы можете пересмотреть свое решение. Хотя это обычное средство первой помощи во многих домах, перекись водорода может быть не лучшим выбором для лечения ожогов.
Продолжайте читать, чтобы узнать больше о перекиси водорода и лучших способах лечения ожогов.
Загляните под раковину на кухне или в ванной. Скорее всего, у вас там скрывается коричневая бутылка с перекисью водорода.
Обычная бытовая бутылка перекиси водорода, которая также известна своей химической формулой h3O2, в основном состоит из воды. Если на этикетке написано, что это 3-процентный раствор, это означает, что он содержит 3 процента перекиси водорода и 97 процентов воды.
Раствор перекиси водорода используется в качестве местного антисептика не менее века.Люди начали использовать перекись водорода для ухода за ранами в 1920-х годах.
В детстве ваши родители могли даже пролить немного перекиси водорода на ваши ободранные колени. Возможно, вы помните, как пенистые белые пузыри поднимаются по поверхности вашей раны.
Эти пузырьки на самом деле являются действующей химической реакцией. Газообразный кислород образуется, когда перекись водорода вступает в реакцию с ферментом каталазой в клетках кожи.
Наблюдая за появлением пузырьков на ободранном колене, вы могли подумать, что перекись водорода убивает все микробы и помогает вашей поврежденной коже заживать быстрее.
И, как указывает обзор 2019 года, перекись водорода действительно обладает антимикробными свойствами. Это может помочь ослабить и смести мусор и другие материалы, которые могут попасть в рану.
Но, как было отмечено в другом исследовании, «в литературе не было замечено никакого положительного эффекта 3% h3O2 для ускорения заживления». Исследования не подтверждают мнение о том, что ваш надежный флакон с 3-процентной перекисью водорода на самом деле помогает быстрее вылечить ожог или рану.
Хотя на первых порах перекись водорода может убить некоторые бактерии, она может вызывать легкое раздражение кожи.Кроме того, это может повредить некоторые клетки кожи и поставить под угрозу процесс образования новых кровеносных сосудов.
И это просто относительно слабый тип перекиси водорода, который вы используете. Более сильные версии могут нанести гораздо более серьезный ущерб.
Лучший выбор: старомодное мягкое мыло и теплая вода. Аккуратно промойте ожог и промокните насухо. Затем нанесите увлажняющий крем и слегка накройте его повязкой.
Легкий ожог - это то, что вы называете поверхностным ожогом. Не выходит за пределы верхнего слоя кожи.Это вызывает некоторую боль и покраснение, но на относительно небольшом участке, возможно, не более 3 дюймов в диаметре.
Если ваш ожог больше или глубже, обратитесь за медицинской помощью.
Вот несколько советов по оказанию первой помощи при легких ожогах:
- Отойдите от источника ожога. Если виновата плита, убедитесь, что она выключена.
- Охладите ожог. Американская академия дерматологии (AAD) рекомендует использовать холодный влажный компресс или погрузить обожженную кожу в прохладную воду примерно на 10 минут.
- Уберите с пути все ограничивающие предметы. Это могут быть украшения, ремни или одежда. Обожженная кожа имеет тенденцию опухать, поэтому поторопитесь.
- Как правило, появляются волдыри, если они у вас есть. Не повреждайте образовавшиеся волдыри. Если волдырь все-таки треснул, аккуратно промойте его водой. Врач может посоветовать нанести на него мазь с антибиотиком.
- Нанесите увлажняющий крем. AAD предлагает вазелин. Другой вариант - нежный увлажняющий лосьон, но избегайте использования сливочного масла, кокосового масла или зубной пасты, которые часто рекомендуются в качестве домашних средств.
- Накройте ожог. Стерильный кусок марли или бинта с антипригарным покрытием защитит обожженную кожу и позволит ей зажить. Однако убедитесь, что повязка свободна, так как давление может быть болезненным.
- Примите обезболивающее. Безрецептурные обезболивающие, такие как ибупрофен, напроксен или ацетаминофен, могут уменьшить воспаление и обеспечить некоторое облегчение.
Ожог первой степени
Ожог первой степени - это незначительный ожог, поражающий только верхний слой кожи.Вы заметите, что ваша кожа красная и сухая, но у вас вряд ли появятся волдыри.
Обычно ожоги первой степени можно лечить дома или в кабинете врача.
Ожог второй степени
Ожог второй степени можно разделить на два подтипа:
- поверхностные ожоги частичной толщины
- глубокие ожоги частичной толщины
Поверхностный ожог частичной толщины выходит за пределы верхнего слоя кожи ( эпидермис) в нижний слой, известный как дерма.
Кожа может стать влажной, красной и опухшей, а также могут появиться волдыри. Если надавить на кожу, она может побелеть - это явление называется побледнением.
Глубокий ожог неполной толщины распространяется еще глубже через дерму. Ваша кожа может быть влажной или восковой и сухой. Волдыри встречаются часто. Ваша кожа не станет белой, если вы надавите на нее.
В зависимости от тяжести ожога вам может потребоваться госпитализация, но не обязательно специализированный ожоговый центр.
Ожог третьей степени
Ожоги третьей степени или ожоги полной толщины проникают через дерму вниз в подкожную клетчатку. Ваша кожа может быть белой, серой или обугленной и черной. У тебя не будет волдырей.
Этот вид ожога требует лечения в специализированном ожоговом центре.
Ожог четвертой степени
Это самый серьезный вид ожога. Ожог четвертой степени распространяется на эпидермис и дерму и часто поражает мягкие ткани, мышцы и кости под ними.Вам также необходимо будет получить помощь в специализированном ожоговом центре.
Легкий ожог, например ожог первой степени, может не потребовать обращения к врачу. Если вы не уверены, серьезен ли ваш ожог, не повредит обратиться к врачу или поставщику медицинских услуг, чтобы определить, насколько серьезен ваш ожог.
Это также хорошая возможность убедиться, что вы правильно лечите ожог. Ваш врач может посоветовать вам следовать стандартным методам лечения легкого ожога, или вам может потребоваться съездить к врачу или в отделение неотложной помощи, чтобы пройти обследование.
В общем, если размер ожога превышает пару квадратных дюймов, или если вы подозреваете, что ожог выходит за пределы верхнего слоя кожи, вероятно, стоит позвонить.
Кроме того, даже если это небольшой ожог, если боль усиливается или у вас появляются симптомы инфекции, позвоните своему врачу.
Как отмечается в обзоре 2015 года, ваша кожа действует как барьер, и ожог может разрушить этот барьер и сделать вас уязвимым для инфекции.
Если вы готовите ужин и случайно дотронулись до горячей сковороды, вы, вероятно, можете просто подержать руку под струей прохладной проточной воды, чтобы охладить кожу.
Вы также можете принять безрецептурное обезболивающее, если продолжаете испытывать легкую боль от ожога, но оставьте перекись водорода там, где вы ее нашли.
Однако не игнорируйте более крупный или глубокий ожог. Эти более серьезные ожоги требуют более серьезного подхода. В случае сомнений обратитесь к медицинскому эксперту.
.Полоскание горла перекисью водорода: применение, преимущества и безопасность
Мы включаем продукты, которые, по нашему мнению, будут полезны нашим читателям. Если вы покупаете по ссылкам на этой странице, мы можем заработать небольшую комиссию. Вот наш процесс.
Перекись водорода - это антисептик, который часто используется для очистки мелких порезов или дезинфекции поверхностей. Из-за своей универсальности перекись водорода является основным продуктом во многих аптечках и аптечках первой помощи, и она легко доступна в большинстве аптек.
Некоторые люди полоскают горло перекисью водорода, чтобы извлечь пользу из ее очищающих свойств.
Жидкость содержит молекулы кислорода и водорода. Это окислитель, а это значит, что он может убивать живые клетки, например бактерии.
Доступны разные концентрации или концентрации перекиси водорода в зависимости от ее предполагаемого использования. Высокие концентрации типичны для промышленного производства. Наиболее распространенная концентрация, продаваемая для домашнего использования, составляет 3 процента.
Каковы потенциальные преимущества полоскания горла перекисью водорода и безопасно ли его использовать? Продолжайте читать, чтобы узнать.
Возможные преимущества полоскания горла перекисью водорода включают:
Отбеливание зубов
Перекись водорода - отбеливающее средство. Фактически, многие виды зубной пасты и жидкости для полоскания рта в магазинах уже содержат это соединение.
В одном исследовании исследователи изучали, могут ли жидкости для полоскания рта с перекисью водорода или 10-процентный гель перекиси карбамида отбеливать зубы более эффективно.
В исследовании участвовали 50 бычьих зубов, окрашенных чаем, и результаты показали, что с течением времени жидкости для полоскания рта с перекисью водорода значительно увеличивали белизну зубов.
Однако они были не так эффективны, как 10-процентный гель перекиси карбамида.
Облегчение боли в горле
Одной из причин боли в горле является бактериальная инфекция. Полоскание горла перекисью водорода может облегчить дискомфорт, уменьшив количество бактерий во рту и помогая избавиться от инфекции.
Перекись водорода может помочь убить бактерии, выделяя кислород, который изменяет среду обитания анаэробных бактерий и подавляет их рост.
Лечение заболеваний десен
Благодаря своим антибактериальным свойствам перекись водорода может помочь в лечении заболеваний десен.
Зубной налет, образующийся на зубах, содержит слизистую пленку бактерий, называемую биопленкой. Перекись водорода выделяет кислород, который помогает уничтожить бактерии.
Рандомизированное исследование 2017 г. разделило 53 участника на группы для тестирования перекиси водорода в качестве средства лечения заболеваний десен.
Одна группа получила хирургическую обработку корня и перекись водорода, а другая группа только что получила хирургическую обработку корня.
Результаты показали, что группа перекиси водорода имела значительно меньше признаков заболевания десен к концу исследования по сравнению с группой, которая получала только санацию корней.
Одним из преимуществ полоскания горла раствором перекиси водорода является то, что он может достигнуть задней части рта и мест, до которых трудно добраться с помощью зубной нити.
Уменьшение мелких язв во рту
Полоскание горла перекисью водорода может помочь в лечении незначительных раздражений во рту, таких как порезы или язвы, поскольку это антисептик.
При надевании на разрез перекись водорода пузырится или пенится, выделяя кислород. Вспенивание помогает очистить область, удалить мертвые клетки и уменьшить количество бактерий.
Перекиси водорода требуется время, чтобы подействовать. Поскольку полоскание происходит относительно быстро, оно не убивает все бактерии во рту, но может уменьшить их количество.
Поделиться на Pinterest Человек должен полоскать горло около 30 секунд, полоская раствор по всему рту.Важно знать, как правильно использовать раствор перекиси водорода, чтобы получить максимальную пользу и избежать нежелательных побочных эффектов.
Чтобы полоскать горло перекисью водорода:
- Используйте 3-процентную концентрацию перекиси водорода.Что-нибудь более сильное может вызвать раздражение.
- Смешайте две части воды с одной частью перекиси водорода.
- Полоскать горло, полоская раствор вокруг рта.
- Наклоните голову назад и продолжайте полоскание горла в течение 30 секунд.
- Выплюнуть раствор.
Перекись водорода может вызвать вспенивание во рту, что является нормальным явлением.
Чтобы избежать раздражения десен, рассмотрите возможность ограниченного использования до нескольких раз в неделю.
Перекись водорода безопасна для большинства людей, если они используют ее правильно.Однако соединение может быть вредным, если человек использует его слишком часто или если концентрация слишком высока.
Никогда не полощите горло пищевой перекисью водорода, концентрация которой составляет 35 процентов. Если человек случайно его проглотит, это может привести к серьезным проблемам с желудочно-кишечным трактом.
При смешивании раствора избегайте вдыхания перекиси водорода, так как она может вызвать раздражение легких.
Состав также может вызвать раздражение глаз, поэтому, выплевывая раствор, будьте осторожны, чтобы не допустить его обратного разбрызгивания на лицо.
Избегайте проглатывания перекиси водорода. Хотя проглатывание небольшого количества 3-процентной концентрации обычно не вызывает серьезных проблем, это может привести к расстройству желудка и рвоте.
Детям нельзя полоскать горло перекисью водорода, если есть опасность ее проглатывания.
В редких случаях возможны более серьезные побочные эффекты. В этом медицинском отчете 2016 года описывается человек, у которого развился химический колит и гастрит после использования 3-процентной жидкости для полоскания рта перекисью водорода во время стоматологической процедуры.
Если раздражение появляется после полоскания горла и не проходит в течение нескольких часов, прекратите использовать для этой цели перекись водорода.
Полоскание горла перекисью водорода может помочь отбелить зубы или уменьшить количество бактерий во рту. Тем не менее, жизненно важно использовать концентрацию не выше 3 процентов и использовать ее в умеренных количествах, чтобы избежать раздражения.
Любой, у кого есть вопросы или опасения по поводу использования перекиси водорода в качестве жидкости для полоскания рта, должен обратиться к стоматологу.
Перекись водорода продается во многих аптеках и в Интернете.
.Отбеливание, обработка ран и многое другое
Быстрый поиск в Интернете использования перекиси водорода для вашей кожи может выявить противоречивые и часто сбивающие с толку результаты. Некоторые пользователи рекламируют его как эффективное средство от прыщей и осветлитель кожи. Иногда его используют в качестве дезинфицирующего средства, но при попадании на кожу он может вызвать серьезные побочные эффекты.
Перекись водорода используется для дезинфекции инструментов, обесцвечивания волос и очистки поверхностей. Он также используется в уходе за полостью рта и в садоводстве. Может быть неприятно знать, что разрекламированное средство для ухода за кожей можно также использовать в качестве бытового чистящего средства.
По данным Национального центра по борьбе с отравлениями, отпускаемые без рецепта (OTC) продукты с перекисью водорода содержат «безопасную» концентрацию 3%, в то время как некоторые промышленные версии содержат до 90%.
Ваш врач может использовать перекись водорода в малых дозах для лечения случаев окислительного стресса на вашей коже. Однако он не считается безопасным продуктом для альтернативного ухода за кожей. Узнайте больше о рисках для вашей кожи и о том, что вам следует использовать вместо этого.
Перекись водорода - это кислота от бледно-голубого до полупрозрачного цвета.Это дезинфицирующее средство доступно для безрецептурного использования в меньших концентрациях, чем те, которые предназначены для промышленного использования. Вы можете купить его в виде салфеток или в виде жидкости для нанесения с помощью ватного диска.
Иногда используется для лечения незначительных случаев следующих заболеваний:
Медицинские работники больше не используют эту кислоту в качестве дезинфицирующего средства. Перекись водорода может непреднамеренно повредить здоровые клетки вокруг ран, которые необходимы для заживления. В исследовании 2012 года сообщалось, что этот негативный побочный эффект от использования перекиси водорода наблюдался у мышей.
Сторонники утверждают, что его ранозаживляющее действие может привести к лечению угрей и другим проблемам с кожей, таким как гиперпигментация. Тем не менее, опасность продукта намного перевешивает любую потенциальную пользу, когда дело касается вашей кожи. Эти осложнения включают:
- дерматит (экзема)
- ожоги
- волдыри
- крапивница
- покраснение
- зуд и раздражение
Помимо побочных эффектов на коже, перекись водорода также может вызывать:
- токсичность или летальный исход при вдыхание или проглатывание
- потенциально более высокий риск рака
- повреждение глаз
- повреждение внутренних органов
Более серьезные риски связаны с более высокими концентрациями и долгосрочным использованием.Если на кожу попала перекись водорода, обязательно тщательно промойте это место водой. Если жидкость попала вам в глаза, может потребоваться промыть ее в течение 20 минут.
Для отбеливания кожи более раннее исследование показало, что вам нужна концентрация от 20 до 30 процентов. Это намного больше, чем 3 процента, которые считаются безопасными для домашнего использования. Риск ожогов и шрамов намного превышает любой потенциальный эффект осветления кожи.
Интерес к перекиси водорода как потенциальному лекарству от прыщей растет.
Крем на основе перекиси водорода под названием Crystacide был так же эффективен, как перекись бензоила, с меньшим количеством зарегистрированных случаев чувствительности. Однако Crystacide содержит только 1 процентную концентрацию и является частью комбинированного продукта.
Посоветуйтесь с дерматологом перед покупкой безрецептурных препаратов. Также доступны некоторые рецептурные формулы.
Вместо того, чтобы рисковать с перекисью водорода, есть другие ингредиенты, которые были исследованы и показали свою безопасность и эффективность.
Обработка ран
Лечение ран зависит от того, есть ли у вас ожог, царапина или открытый порез. Ваш подход к лечению должен быть направлен на то, чтобы остановить кровотечение, одновременно защищая кожу, чтобы она могла зажить, не повреждая и не заражаясь. Попробуйте выполнить следующие действия:
- Наложите повязки или бинты.
- Увеличьте потребление витамина C.
- Убедитесь, что в вашем рационе достаточно витамина A и цинка.
- Принимайте безрецептурные обезболивающие (ацетаминофен, ибупрофен) только при необходимости.
Лечение прыщей и осветления кожи
Сначала вам нужно подумать, вызваны ли прыщи воспалением или нет.
Черные точки и белые точки - это два типа невоспалительных угрей. Их можно обработать салициловой кислотой, чтобы избавиться от лишних мертвых клеток кожи, застрявших в порах.
Воспалительные поражения, такие как узелки, папулы и кисты, могут нуждаться в пероксиде бензоила. Ваш дерматолог может порекомендовать пероральные препараты в более тяжелых случаях.
Если вы хотите осветлить кожу от шрамов и других причин гиперпигментации, рассмотрите следующие варианты:
- альфа-гидроксикислоты, такие как гликолевая кислота
- гидрохинон, отбеливающее средство
- койевая кислота, более натуральный ингредиент
- витамин C
Хотя перекись водорода иногда используется в качестве дезинфицирующего средства для кожи, вы никогда не должны использовать этот продукт без предварительной консультации с врачом. Чистые формулы, которые вы можете купить в аптеке, не доказали свою эффективность при любых других проблемах и состояниях кожи.
Поговорите со своим дерматологом о других безрецептурных продуктах и профессиональных процедурах, которые вы могли бы использовать для лечения прыщей, гиперпигментации и других проблем, связанных с уходом за кожей.
.Новый процесс может сделать перекись водорода доступной в отдаленных местах
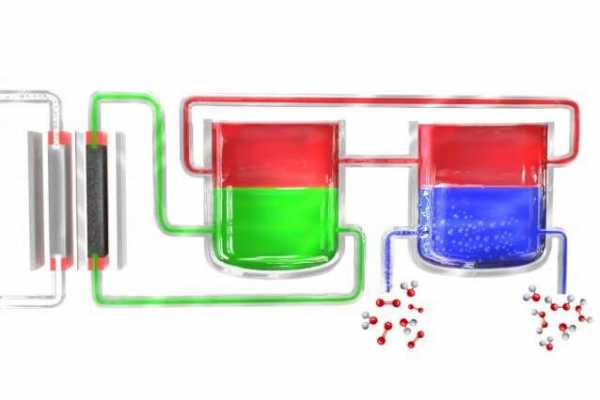 В новом способе портативного производства перекиси водорода электролизер (слева) разделяет воду на водород и кислород. Атомы водорода первоначально образуются в материале электролита (зеленый), который передает их материалу-посреднику (красный), который затем переносит их в отдельный блок, где посредник контактирует с богатой кислородом водой (синий), где водород соединяется с ним с образованием перекиси водорода.Затем посредник возвращается, чтобы снова начать цикл. Предоставлено: Массачусетский технологический институт.
В новом способе портативного производства перекиси водорода электролизер (слева) разделяет воду на водород и кислород. Атомы водорода первоначально образуются в материале электролита (зеленый), который передает их материалу-посреднику (красный), который затем переносит их в отдельный блок, где посредник контактирует с богатой кислородом водой (синий), где водород соединяется с ним с образованием перекиси водорода.Затем посредник возвращается, чтобы снова начать цикл. Предоставлено: Массачусетский технологический институт. Перекись водорода, полезное универсальное дезинфицирующее средство, содержится в большинстве медицинских шкафов в развитых странах. Но в отдаленных деревнях в развивающихся странах, где он может сыграть важную роль в области здравоохранения и санитарии, его может быть трудно найти.
Теперь процесс, разработанный в Массачусетском технологическом институте, может привести к простому, недорогому, портативному устройству, которое могло бы непрерывно производить перекись водорода только из воздуха, воды и электричества, обеспечивая способ стерилизации ран, поверхностей для приготовления пищи и даже источников воды. .
Новый метод описан на этой неделе в журнале Joule в статье студентов Массачусетского технологического института Александра Мюррея, Саага Воскяна, Марселя Шрайера и профессоров Массачусетского технологического института Т. Алана Хаттона и Йогеша Сурендраната.
Даже при низких концентрациях перекись водорода является эффективным антибактериальным средством, и после выполнения своей функции стерилизации она распадается на обычную воду, в отличие от других агентов, таких как хлор, которые могут оставлять нежелательные побочные продукты при его производстве и использовании.
Перекись водорода - это просто вода с присоединенным дополнительным атомом кислорода - это h3O2 вместо h3O. Этот дополнительный кислород относительно слабо связан, что делает его очень реактивным химическим веществом, стремящимся окислить любые другие молекулы вокруг себя. Он настолько реактивен, что в высоких концентрациях его можно использовать в качестве ракетного топлива, и даже при концентрации в 35 процентов требуются особые процедуры обращения и транспортировки. Тип, используемый в качестве домашнего дезинфицирующего средства, обычно содержит всего 3 процента перекиси водорода и 97 процентов воды.
Поскольку высокие концентрации трудно транспортировать, а низкие концентрации, в основном вода, неэкономичны для транспортировки, материал часто трудно достать в местах, где он может быть особенно полезен, например, в отдаленных населенных пунктах с неочищенной водой. (Бактерии в системах водоснабжения можно эффективно контролировать, добавляя перекись водорода.) В результате многие исследовательские группы по всему миру применяют подходы к разработке той или иной формы портативного оборудования для производства перекиси водорода.
Большая часть перекиси водорода, производимой в промышленно развитых странах, производится на крупных химических заводах, где метан или природный газ используется в качестве источника водорода, который затем вступает в реакцию с кислородом в каталитическом процессе при высокой температуре. Этот процесс энергоемкий и нелегко масштабируемый, требует большого оборудования и стабильной подачи метана, поэтому он не подходит для небольших установок или удаленных мест.
«Существует растущее сообщество, интересующееся портативной перекисью водорода, - говорит Сурендранат, - потому что она понимает, что она действительно удовлетворит множество потребностей, как с промышленной точки зрения, так и с точки зрения здоровья человека и санитарии.«
Другие процессы, разработанные до сих пор для потенциально переносимых систем, имеют ключевые ограничения. Например, большинство катализаторов, которые способствуют образованию пероксида водорода из водорода и кислорода, также производят много воды, что приводит к низким концентрациям желаемого продукта. Кроме того, в процессах, включающих электролиз, как в этом новом процессе, часто возникают трудности с отделением произведенной перекиси водорода от материала электролита, используемого в процессе, что опять же приводит к низкой эффективности.
Сурендранат и остальная часть команды решили проблему, разбив процесс на два отдельных этапа. Сначала электричество (в идеале от солнечных батарей или ветряных мельниц) используется для разложения воды на водород и кислород, а затем водород вступает в реакцию с молекулой-носителем. Эта молекула - соединение, называемое антрохиноном, в этих первоначальных экспериментах - затем вводится в отдельную реакционную камеру, где она встречается с кислородом, взятым из внешнего воздуха, и пара атомов водорода связывается с молекулой кислорода (O2), образуя водород. перекисью.В процессе молекула-носитель восстанавливается в исходное состояние и возвращается для выполнения цикла заново, поэтому ни один из этих материалов не расходуется.
По словам Сурендраната, этот процесс может решить множество проблем, сделав более доступными чистую воду, средства для оказания первой помощи при ранениях и стерильные поверхности для приготовления пищи в местах, где их в настоящее время мало или они недоступны.
«Даже при довольно низких концентрациях вы можете использовать его для дезинфекции воды от микробных загрязнений и других патогенов», - говорит Сурендранат.И, добавляет он, «при более высоких концентрациях его можно использовать даже для того, что называется продвинутым окислением», где в сочетании с ультрафиолетовым светом он может использоваться для обеззараживания воды даже сильных промышленных отходов, например, от горных работ или гидроразрыва пласта. .
Так, например, переносная установка по производству перекиси водорода может быть установлена рядом с местом гидроразрыва пласта или добычи и использоваться для очистки сточных вод, а затем перемещена в другое место после прекращения операций на исходном участке.
В этой первоначальной экспериментальной установке концентрация производимой перекиси водорода все еще низкая, но дальнейшее проектирование системы должно привести к возможности производить более концентрированную продукцию, говорит Сурендранат.«Один из способов сделать это - просто увеличить концентрацию медиатора, и, к счастью, наш медиатор уже использовался в проточных батареях при действительно высоких концентрациях, поэтому мы думаем, что есть способ увеличить эти концентрации», он говорит.
«Это своего рода удивительный процесс, - говорит он, - потому что вы берете много вещей, воды, воздуха и электричества, которые вы можете получить на месте, и используете их для производства этого важного химического вещества, которое можно использовать для фактической очистки окружающая среда, санитария и качество воды.«
«Заслуживает внимания способность создавать раствор перекиси водорода в воде без электролитов, соли, основания и т. Д., Которые присущи другим электрохимическим процессам», - говорит Шеннон Шталь, профессор химии из Университета Висконсина. кто не принимал участия в этой работе. Шталь добавляет, что «доступ к бессолевым водным растворам h3O2 имеет большое значение для практического применения».
Шталь говорит: «Эта работа представляет собой инновационное применение опосредованного электролиза.«Опосредованная электрохимия предоставляет средства для объединения обычных химических процессов с электрохимией, и это особенно убедительная демонстрация этой концепции. … Есть много потенциальных применений этой концепции ».
Вода + воздух + электричество = перекись водорода
Дополнительная информация: «Электросинтез пероксида водорода методом межфазного катализа." Джоуль (2019). DOI: 10.1016 / j.joule.2019.09.019 Информация журнала: Джоуль Предоставлено Массачусетский Технологический Институт
Этот рассказ переиздан с разрешения MIT News (web.mit.edu/newsoffice/), популярный сайт, на котором освещаются новости об исследованиях, инновациях и обучении MIT.
Цитата : Новый процесс может сделать перекись водорода доступной в отдаленных местах (2019, 24 октября) получено 21 ноября 2020 с https: // физ.org / новости / 2019-10-перекись водорода-remote.html
Этот документ защищен авторским правом. За исключением честных сделок с целью частного изучения или исследования, никакие часть может быть воспроизведена без письменного разрешения. Контент предоставляется только в информационных целях.
.