уборка помещений любой сложности!
Полученный из пероксида водорода кислород нельзя определять по запаху
Верны ли следующие суждения о правилах безопасной работы в химической лаборатории? А. Полученный из пероксида водорода кислород нельзя определить по запаху. Б. Водород, полученный в результате взаимо
Задание № 11301
Верны ли следующие суждения о правилах безопасной работы в химической лаборатории?
А. Полученный из пероксида водорода кислород нельзя определить по запаху.
Б. Водород, полученный в результате взаимодействия цинка с соляной кислотой, при поджигании не надо проверять на чистоту.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Показать ответ
Комментарий:Кислород нельзя определить по запаху, потому что он не пахнет;
Водород надо проверять на чистоту перед поджиганием, так как он способен образовывать взрывоопасные смеси.
Ответ: 1Улучши свой результат с курсами ЕГЭ/ОГЭ/ВПР на egevpare.ru
Предложи свой вариант решения в комментариях 👇🏻
Вариант 5
Задание №1.
На приведенном рисунке
изображена модель атома
1. Бериллия
2. Гелия
3. Натрия
4. Лития
Объяснение: у атома элемента, схема которого приведена на рисунке, два электронных слоя, на первом слое два электрона и на втором тоже 2. Значит это элемент с порядковым номером 4, а это - бериллий. Правильный ответ - 1.
Задание №2.
Основным является высший оксид каждого из химических элементов, имеющих в периодической системе Д.И. Менделеева порядковые номера:
1. 11, 7, 16
2. 19, 15, 17
3. 12, 3, 20
4. 6, 14, 16
Объяснение: основными оксидами являются оксиды щелочных и щелочноземельных металлов. Свойства основных оксидов можно посмотреть здесь. Из перечисленных выбираем магний, литий и кальций. Правильный ответ - 3.
Задание №3.
Ковалентной неполярной связью образовано каждое из веществ, формулы которых:
1. Br2, h3, O2
2. O2, S8, h3S
3. O2, h3, h3O
4. CO, Ch5, h3
Объяснение: ковалентная неполярная связь образуется между атомами одного и того же элемента, поэтому выбираем бром, водород и кислород. Правильный ответ - 1.
Задание №4.
Отрицательная степень окисления химических элементов численно равна:
1. Номеру группы в периодической системе
2. Числу электронов, недостающих до завершения внешнего электронного слоя
3. Числу электронных слоев в атоме
4. Номеру периода, в котором находится элемент в периодической системе
Объяснение: отрицательная степень окисления показывает сколько электронов не хватает атому до заполнения электронного слоя, так как отрицательная степень окисления - это наличие электронов (ситуация, при которой атом электроны забрал). Правильный ответ - 2.
Задание №5.
К сложным веществам относится:
1. Красный фосфор
2. Алмаз
3. Воздух
4. Угарный газ
Объяснение: сложные вещества состоят из атомов двух или более элементов. Красный фосфор и алмаз - простые вещества, воздух - смесь газов, угарный газ - сложное вещество - СО. Правильный ответ - 4.
Задание №6.
Реакции замещения соответствует уравнение:
1. 2NaOH + CO2 = Na2CO3 + h3O
2. NaCl + AgNO3 = NaNO3 + AgCl
3. CuO + h3SO4 = CuSO4 + h3O
4. Fe2O3 + 3C = 2Fe + 3CO
Объяснение: реакция замещения - реакция при которой одни атомы или функциональные группы меняются на другие. Из приведенных, реакцией замещения является последняя, в ней углерод замещает железо в оксиде. Правильный ответ - 4.
Задание №7.
Верны ли следующие суждения об электролитической диссоциации солей?
А. Все соли при диссоциации образуют катионы металлов, катионы водорода и анионы кислотных остатков.
Б. Соли в процессе диссоциации образуют катионы металлов и анионы кислотных остатков.
1. Верно только А
2. Верно только Б
3. Верны оба суждения
4. Оба суждения неверны
Объяснение: первое утверждение неверно, так как катионы металлов, катионы водорода и анионы кислотных остатков при диссоциации дают только кислые соли. А второе утверждение верно. Правильный ответ - 2.
Задание №8.
Осадок белого цвета, нерастворимый в кислотах и щелочах, образуется в результате реакции, сокращенное ионное уравнение которой:
1. Zn²+ + 2OH‾ = Zn(OH)2
2. Fe²+ + 2OH‾ = Fe(OH)2
3. Ca²+ + CO3²‾ = CaCO3
4. Ba²+ + SO4²‾ = BaSO4
Объяснение: карбонат кальция растворяется в кислотах, гидроксиды образуют комплексы в щелочах. Сульфат бария нерастворим ни в кислотах ни в щелочах. Правильный ответ - 4.
Задание №9.
Цинк вытесняет металл из раствора:
1. Нитрата кальция
2. Нитрата калия
3. Нитрата меди (II)
4. Сульфата алюминия
Объяснение: цинк может вытеснить только менее активный металл. Среди кальция, калия, меди и алюминия слабее цинка только медь (см. ряд напряжений металлов). Правильный ответ - 3.
Задание №10.
Верны ли следующие суждения об оксидах?
А. При взаимодействии кислотных оксидов с основными образуются соли.
Б. Оксид серы (VI) реагирует как с гидроксидом натрия, так и с оксидом калия.
1. Верно только А
2. Верно только Б
3. Верны оба суждения
4. Оба суждения неверны
Объяснение: оба суждения верны, такой вывод можно сделать, вспомнив химические свойства оксидов. Правильный ответ - 3.
Задание №11.
Раствор серной кислоты не взаимодействует с веществом, формула которого:
1. CuO
2. Cu
3. Ca(OH)2
4. Ba(NO3)2
Объяснение: раствор серной кислоты, как и все кислоты (кроме азотной) не реагирует с металлами, стоящими в ряду напряжений металлов после водорода. Таким металлом является медь. Правильный ответ - 2.
Задание №12.
Химическая реакция возможна между солями:
1. Na2CO3 и KCl
2. Al2(SO4)3 и NaNO3
3. AlCl3 и K2SO4
4. AgNO3 и Na3PO4
Объяснение: реакция обмена возможна только при образовании газа или осадка. Осадком является фосфат серебра, образующийся в последней реакции. Запишем ее.
3AgNO3 + Na3PO4 = 3NaNO3 + Ag3PO4↓
Правильный ответ - 4.
Задание №13.
Верны ли следующие суждения об обращении с газами в процессе лабораторных опытов?
А. Полученный из перекиси водорода кислород нельзя определять по запаху.
Б. Водород, полученный в аппарате Киппа, не надо проверять на чистоту.
1. Верно только А
2. Верно только Б
3. Верны оба суждения
4. Оба суждения неверны
Объяснение: кислород (как и все остальные газы) в лаборатории нельзя проверить по запаху, так как кислород запаха не имеет. Водород всегда нужно проверять на чистоту вне зависимости от способа получения. Правильный ответ - 4.
Задание №14.
В химической реакции, уравнение которой
2KI + SO3 = K2SO3 + I2
окислителем является
1. I‾ в иодиде калия
2. О²‾ в оксиде серы (VI)
3. К+1 в иодиде калия
4. S+6 в оксиде серы (VI)
Объяснение: в данной окислительно-восстановительной реакции йод и сера меняют степень окисления. Запишем баланс.
S(+6) +2e → S(+4) - окислитель
2I(-1) -2e → I2(0) - восстановитель
То есть, окислителем является сера в оксиде серы (VI).
Правильный ответ - 4.
Задание №15.
Какое распределение массовых долей элементов соответствует количественному составу гидроксида калия?
1. 28,5,1,5, 70
2. 28,5, 3,5 67
3. 43, 3, 54
4. 42, 5, 53
Объяснение:
Ar(K) = 39 г/моль
Ar(H) = 1 г/моль
Ar(O) = 16 г/моль
Mr(KOH) = 56 г/моль
ω(К) = 39/56 х 100% = 70%
ω(Н) = 1/56 х 100% = 1,8%
ω(О) = 16/56 х 100% = 28,2%
Правильный ответ - 1.
Задание №16.
Общим для хлора и брома является
1. Наличие на внешнем электронном слое одинакового числа электронов
2. Наличие четырех электронных слоев в атомах
3. Одинаковое физическое состояние образованных ими простых веществ
4. Образование ими высших оксидов с общей формулой Э2О7
5. То, что они являются более сильными окислителями, чем фтор
Объяснение: и хлор и бром находятся в седьмой группе и называются галогенами, то есть на внешнем электронном слое оба элемента имеют одинаковое количество электронов - 7. В простом состоянии хлор является газом, бром - жидкостью. Оба образуют высшие оксиды с формулой Э2О7. Фтор является более сильным окислителем, чем оба эти галогена. Правильный ответ - 1.
Задание №17.
Для стеариновой кислоты характерны следующие утверждения
1. Хорошо растворяется в воде
2. Относится к кислородсодержащим органическим соединениям
3. Изменяет окраску лакмуса
4. Не содержит функциональных групп
5. Взаимодействует с кислородом
Объяснение: формула стеариновой кислоты - С8Н36О2, относится к карбоновым кислотам, то есть имеет функциональную группу - карбоксильную. Нерастворима в воде. Вступает в реакцию горения с кислородом (реакция идет до углекислого газа и воды). Правильный ответ - 25.
Задание №18.
Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти свойства.
Вещества
А. K2CO3(р-р) и Na2SiO3(р-р)
Б. Na2CO3(тв) и CaCO3(тв)
В. K2SO4(р-р) и KOH(р-р)
Реактив
1. CuCl2(р-р)
2. HNO3(р-р)
3. MgO
4. h3O
Объяснение: карбонат калия и силикат натрия можно различить при помощи азотной кислоты, в первой реакции выделяется углекислый газ. Твердые карбонат натрия и карбонат кальция различим водой, потому что карбонат натрия растворим в воде, а карбонат кальция - нерастворим (белый осадок). Сульфат калия и гидроксид калия отличить друг от друга можно при помощи раствора хлорида меди, так как образующийся во второй реакции гидроксид меди синего цвета и нерастворим в воде. Правильный ответ - 241.
Задание №19.
Установите соответствие между названием вещества и реагентами, с которыми это вещество может взаимодействовать.
Название вещества
А. Оксид углерода (II)
Б. Оксид углерода (IV)
В. Карбонат натрия
Реагенты
1. Ba(OH)2(р-р), Mg
2. CO2(р-р), HCl(р-р)
3. Fe2O3, O2
4. h3O, SO2
Объяснение: оксид углерода (II) реагирует с оксидом железа и кислородом. Магний горит в углекислом газе: 2Мg + CO2 = C + 2MgO и еще диоксид углерода реагирует с гидроксидом бария. CO2 + Ba(OH)2 = BaCO3 + h3O
Карбонат натрия вступает в реакцию с углекислым газом и соляной кислотой.
Правильный ответ - 312.
Задание №20.
Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой
h3S + HClO3 → S + HCl + h3O
Определите окислитель и восстановитель.
Объяснение: сера и хлор меняют степень окисления в данной окислительно-восстановительной реакции. Запишем баланс.
S(-2) -2e → S(0) | 3 - восстановитель
Cl(+5) +6e → Cl(-1) | 1 - окислитель
Расставляем коэффициенты.
3h3S + HClO3 → 3S + HCl + 3h3O
Задание №21.
Определите объем (н.у.) оксида углерода (IV), образующегося при растворении 110 г известняка, содержащего 92% карбоната кальция, в избытке соляной кислоты.
Объяснение: запишем уравнение реакции.
CaCO3 + 2HCl = CaCl2 + h3O + CO2↑
Найдем массу чистого известняка.
m(СaCO3) = 110 x 0,92 = 101,2 г
Находим количество вещества карбоната кальция.
n(CaCO3) = 101,2/100 = 1 моль
Количество вещества карбоната кальция равно количеству вещества углекислого газа.
n(CaCO3) = n(CO2) = 1 моль
Найдем объем углекислого газа.
V(CO2) = 1 x 22,4 = 22,4 л
Ответ: объем углекислого газа равен 22,4 л.
Задание №22.
Даны вещества: Al, I2, NaI, NaOH, HNO3. Используя воду и необходимые вещества только из этого списка, получите в две стадии гидроксид алюминия. Опишите признаки проведения реакций. Для реакции ионного обмена напишите сокращенное ионное уравнение реакции.
Объяснение: алюминий реагирует с йодом: 2Al + 3I2 → 2AlI3
Затем йодид алюминия реагирует с гидроксидом натрия, при этом образуется нерастворимый гидроксид алюминия: AlI3 + 3NaOH → 3NaI + Al(OH)3↓
Запишем сокращенное ионное уравнение.
Al³+ + OH‾ → Al(OH)3↓
| № | Ответ | Правильный ответ | Первичный балл |
|---|---|---|---|
| 1 | 3 | 3 | 1 |
Химическому элементу, в атоме которого распределение электронов по слоям 2е, 8е, 7е, соответствует символ этого элемента, формула высшего оксида и водородного соединения: 1) Сl,Сl2O,НСl 2) С, СO2, СН4 3) Сl,Сl2O7,НСl 4) N, N2O5, NH3 | |||
Общее число электронов равно порядковому номеру элемента. e- = 17. Это хлор. | |||
| 2 | 1 | 1 | 1 |
Амфотерным является высший оксид каждого из , имеющих в порядковые номера: 1) 4,13, 30 2) 6, 11, 16, 3) 19,12, 3 4) 6, 14, 17 | |||
BeO, Al2O3, ZnO — амфотерные оксиды. | |||
| 3 | 2 | 2 | 1 |
Ковалентной неполярной связью образовано каждое из веществ в группе: 1) СO2, SiCl4, НВr 2) H2, O2, S8 3) Fe2O3, CaS, К2O 4) НСl, NaCl, PH3 | |||
Ионная связь образуется между атомами металлов и неметаллов. Ковалентная полярная связь образуется между атомами разных элементов-неметаллов. Ковалентная неполярная связь образуется между атомами одного и того же элемента-неметалла. Металлическая связь присуща металлам. H, O, S — неметаллы. | |||
| 4 | 2 | 2 | 1 |
Максимально возможную степень окисления атом серы проявляет в соединении 1) H2S 2) K2SO3 3) FeS2 4) Li2S | |||
Из предложенных вариантов наибольшая степень окисления серы +4 (K2SO3). | |||
| 5 | 4 | 4 | 1 |
Сложным является каждое из двух веществ: 1) вода и хлор 2) вода и водород 3) водород и кварц 4) бензол и вода | |||
Сложные вещества — вещества, состоящие из 2 и более элементов | |||
| 6 | 2 | 2 | 1 |
Признаком химической реакции между растворами сульфата меди(II) и гидроксида калия является: 1) выделение газа 2) выпадение осадка 3) появление запаха 4) поглощение теплоты | |||
CuSO4+2KOH=K2SO4+Cu(OH)2↓ | |||
| 7 | 2 | 2 | 1 |
Сульфит-ионы образуются при электролитической диссоциации 1) MgSO4 2) K2SO3 3) SrSO3 4) Li2S | |||
Сульфит-анионы SO32- образуются только при диссоциации растворимых солей. | |||
| 8 | 3 | 3 | 1 |
Краткое ионное уравнение Н+ + ОН = Н2O отвечает взаимодействию веществ: 1) Н2СO3 и КOН 2) Н3РO4 и Fe(OH)2 3) НСl и КОН 4) НСl и Fe(OH) | |||
Практическая работа №4 7 класс. Получение кислорода из пероксида водорода и доказательство его наличия.
Практическая работа №4 7 класс.
Получение кислорода из пероксида водорода и доказательство его наличия.
Цель: 1) познакомиться со способом получения кислорода в лаборатории и его химическим свойством - поддерживать горение;
2) научиться собирать газ в сосуд вытеснением воздуха;
3) совершенствовать умение работать с простейшими приборами.
С техникой безопасности знаком (а)________________________________
План:
1.Налейте в стакан по 8—15 мл раствора пероксида водорода.
2.Добавьте в стакан (на кончике шпателя) оксид марганца (IV). Что наблюдаете?
3. Проверяем наличие кислорода тлеющей лучинкой.
4.Лучинку не макните в пероксид водорода.
5.Напишите уравнение реакции.
2 H2O2 = 2 H2O + O2
Пошла бурная реакция между пероксидом водорода и оксидом марганца (IV).
Тлеющая лучинка загорелась ярким пламенем.
Второй способ получения кислорода.
Получение кислорода из перманганата калия(марганцовки) и гидроперита
Получение кислорода из... — Youtube.com
youtube.com/watch?v=-kem8rOavEo
В основание пробирки, в которой находится перманганат калия поместить комочек ваты и закрыть пробирку газоотводной трубкой.
Закрепить пробирку держателем. Опустить конец газоотводной трубки в пустую пробирку.
Нагреть пробирку с перманганатом калия, соблюдая правила нагревания.
Соберите кислород в пробирку способом вытеснения воздуха. Проверьте его наличие с помощью тлеющей лучинки. Прекратите нагревание.
оформите отчет о работе: а) зарисуйте прибор для сбора кислорода, сделайте соответствующие подписи; б) заполните таблицу, дописав предложения и закончив уравнения реакций.
KMnO4 K2MnO4 + … + …
2. Нагревание пробирки с перманганатом калия и собирание кислорода методом вытеснения воздуха
В пробирке происходит…
Пробирку для сбора кислорода следует держать … дном, потому что…
3. Доказательство наличия кислорода в пробирке с помощью тлеющей лучинки
Тлеющая лучинка…
Кислород поддерживает …
С + О2 =
ВЫВОД. Один из способов получения кислорода в лаборатории – разложение КMnO4. Кислород – газ без цвета и запаха, тяжелее воздуха в 1,103 раза (Mr(O2) = 32, Mr(возд.) = 29, из чего следует 32/29 1,103), малорастворим в воде. Вступает в реакции с простыми веществами, образуя оксиды. Приведите рабочее место в порядок. Сдайте тетради на проверку.
Подумайте и ответьте:
Кислород в лаборатории получают при нагревании перманганата калия. Полученный газ можно собрать путем вытеснения воздуха, используя прибор;
Какую посуду надо использовать при работе?
А) чистую Б) грязную В) с трещинами Г) какая есть, ту и использовать
Пробирку нагревают
А) в верхней части пламени Б) в нижней части пламени В) не имеет значения
Спиртовку тушат
А) задувая огонь Б) колпачком В) руками
Почему нельзя пользоваться грязной посудой?
А) неприятно брать в руки Б) можно получить неточный результат
Контрольный тест по теме Водород и кислород
Тестирование по теме: « Водород и кислород»
Часть 11.Какой элемент самый распространенный на земле
а) водород б) кислород в) железо г) гелий
2.Водород в лаборатории можно получить
а) при взаимодействии кислоты с любым металлом
б) разложением воды
в) реакцией активного металла с водой
г) разложением солей нитратов
3.Для получения кислорода невозможно использовать а) воду, б) перекись водорода
в) кислоту г) соль
4.Водородом богаче вещество:
а) H2O б)H2O2 в)CH4 г) H2SO4
5.К физически свойствам кислорода не относится
а) газ, без цвета, вкуса и запаха
б) хорошо растворим в воде
в) тяжелее воздуха
г) сжижается при давлении
6.Получить чистый металл можно восстановлением водорода
а) Fe(OH)2 б) Fe2(SO4)3 в)FeBr3 г) FeO
7.Химические свойства водорода как восстановителя характеризуют свойства
а) Mg + H2=
б) K+H2=
в) CuO+ H2=
г) AI+ H2=
8. Установите последовательность коэффициентов в уравнении H2 +Cr2O3= Cr+…
а) 2,3,3,1 б) 3,2,1,3 в)3,1,2,3 г)1,1,2,3
9. Водород взаимодействует
а) Na б) CH4 в) ZnO г)Br2
10 Кислород взаимодействует
а) C б) NH3 в) AI г) ZnCI2
Часть 2
1. Составьте уравнения реакции при помощи, которых можно осуществить следующие превращения
H2O---- H2----HCI-----CaCI2
|
Fe----FeSO4---- Fe(OH)2
2.Допишите уравнение реакции и составьте электронный баланс
СS2+ О2=
3.При восстановлении водородом оксида железа (III) массой 320 г содержащей 5% примеси. Выход продукта железа составляет 92%. Определите массу образовавшегося железа.
Часть 1
1.Какой элемент самый распространенный во вселенной
а) водород б) кислород в) железо г) гелий
2.Кислород в лаборатории можно получить
а) реакций разложения воды
б) разложение перманганата калия
в) реакцией фотосинтеза
г) под давлением из воздуха
3. Для получения водорода из кислот можно использовать группы металлов
а) K, Au, Zn б) Cu, Ca, Fe
в) Na, Mg, Pb г ) Cr, AI, Hg
4. Кислородом богаче вещество
а) H2O б ) Na2O в)HNO3 г) SO2
5.К физически свойствам водорода не относится
а) газ, без цвета, вкуса и запаха
б) хорошо растворим в воде
в) легче воздуха
г) горюч
6.Получить чистый металл можно восстановлением водорода
а) ZnO б ) Zn (OH)2 в) Zn(NO3)3 г) ZnCI2
7.Химические свойства водорода как окислителя характеризуют свойства
а) N2+ H2=
б) Ca+H2=
в) FeO+H2=
г) AI+HCI=
8. Установите последовательность коэффициентов в уравнении H2 +Sb2O5= Sb+…
А) 1,5,2,5 б) 5,1,2,5 в)1.5,1,5 г) 5,2,1,5
9. Водород взаимодействует:
а) CuO б) K в) CI2 г) Zn (OH)2
10 Кислород взаимодействует
а) CH4 б) Na2O в)FeBr3 г) P
Часть 2
1. Составьте уравнения реакции при помощи, которых можно осуществить следующие превращения
Na----NaOH----Cu(OH)2-----CuO------Cu
|
H2----Zn-----ZnCI2
2.Допишите уравнение реакции и составьте электронный баланс
NH3+ О2=
3.При окислении сернистого газа (оксида серы (IV)) массой 128 г. содержащего 10% примеси. Выход продукта составил 88%. Определите объем выделившегося SO3
Ответы
1вариант
б
в
в
в
б
г
в
в
а,в,г
а,б.в
2
вариант
а
б
в
а
б
а
б
а
а,б.в
а,г
Получение водорода и кислорода — урок. Химия, 8–9 класс.
Получение кислорода
В лаборатории кислород получают разложением перманганата калия при нагревании или разложением пероксида водорода в присутствии катализатора:
2KMnO4=tK2MnO4+MnO2+O2↑.
2h3O2=MnO22h3O+O2↑.
Собирают кислород вытеснением воды или вытеснением воздуха.
Прибор для получения кислорода из перманганата калия
и собирания вытеснением воды
Прибор для получения кислорода
из пероксида водорода и собирания
вытеснением воздуха
Обнаружить выделившийся кислород можно с помощью тлеющей лучинки. В сосуде с кислородом лучинка разгорается ярким пламенем.
Получение водорода
В лаборатории водород получают действием соляной или разбавленной серной кислоты на металлы (цинк, железо, алюминий).
Zn+2HCl=ZnCl2+h3↑,
Zn+h3SO4=ZnSO4+h3↑.
Собирают водород вытеснением воды или воздуха. Сосуд для водорода при вытеснении воздуха располагают дном вверх.
Доказать наличие водорода в пробирке можно, если поднести её к пламени спиртовки. Водород взрывается, и раздаётся характерный хлопок.
Отбеливание, обработка ран и многое другое
Быстрый поиск в Интернете использования перекиси водорода для вашей кожи может выявить противоречивые и часто сбивающие с толку результаты. Некоторые пользователи рекламируют его как эффективное средство от прыщей и осветлитель кожи. Иногда его используют в качестве дезинфицирующего средства, но при попадании на кожу он может вызвать серьезные побочные эффекты.
Перекись водорода используется для дезинфекции инструментов, обесцвечивания волос и очистки поверхностей. Он также используется в уходе за полостью рта и в садоводстве. Может быть неприятно знать, что разрекламированное средство для ухода за кожей можно также использовать в качестве бытового чистящего средства.
По данным Национального центра по борьбе с отравлениями, отпускаемые без рецепта (OTC) продукты с перекисью водорода содержат «безопасные» концентрации 3 процента, в то время как некоторые промышленные версии содержат до 90 процентов.
Ваш врач может использовать перекись водорода в малых дозах для лечения случаев окислительного стресса на вашей коже. Однако он не считается безопасным продуктом для альтернативного ухода за кожей. Узнайте больше о рисках для вашей кожи и о том, что вам следует использовать вместо этого.
Перекись водорода - это кислота от бледно-голубого до полупрозрачного цвета.Это дезинфицирующее средство доступно для безрецептурного использования в меньших концентрациях, чем те, которые предназначены для промышленного использования. Вы можете купить его в виде салфеток или в виде жидкости для нанесения с помощью ватного диска.
Иногда используется для лечения незначительных случаев следующих заболеваний:
Медицинские работники больше не используют эту кислоту в качестве дезинфицирующего средства. Перекись водорода может непреднамеренно повредить здоровые клетки вокруг ран, которые необходимы для заживления. В исследовании 2012 года сообщалось, что этот негативный побочный эффект от использования перекиси водорода наблюдался у мышей.
Сторонники утверждают, что его заживляющие эффекты могут привести к лечению прыщей и других проблем с кожей, таких как гиперпигментация. Тем не менее, опасность продукта намного перевешивает любую потенциальную пользу, когда речь идет о вашей коже. Эти осложнения включают:
- дерматит (экзема)
- ожоги
- волдыри
- крапивница
- покраснение
- зуд и раздражение
Помимо побочных эффектов кожи, перекись водорода также может вызывать:
- токсичность или летальный исход при вдыхание или проглатывание
- потенциально более высокий риск рака
- повреждение глаз
- повреждение внутренних органов
Более серьезные риски связаны с более высокими концентрациями и долгосрочным использованием.Если на кожу попала перекись водорода, обязательно тщательно промойте это место водой. Если жидкость попала вам в глаза, может потребоваться промыть ее в течение 20 минут.
Для отбеливания кожи более раннее исследование показало, что вам нужна концентрация от 20 до 30 процентов. Это намного выше, чем 3 процента, которые считаются безопасными для домашнего использования. Риск ожогов и шрамов намного превышает любой потенциальный эффект осветления кожи.
Интерес к перекиси водорода как потенциальному лекарству от прыщей растет.
Крем на основе перекиси водорода под названием Crystacide был так же эффективен, как перекись бензоила, с меньшим количеством зарегистрированных случаев чувствительности. Однако Crystacide содержит только 1 процентную концентрацию и является частью комбинированного продукта.
Посоветуйтесь с дерматологом перед покупкой безрецептурных препаратов. Также доступны некоторые рецептурные формулы.
Вместо того, чтобы рисковать с перекисью водорода, есть другие ингредиенты, которые были исследованы и показали свою безопасность и эффективность.
Обработка ран
Лечение ран зависит от того, есть ли у вас ожог, царапина или открытый порез. Ваш подход к лечению должен быть направлен на то, чтобы остановить кровотечение, одновременно защищая кожу, чтобы она могла заживать, не повреждая и не заражаясь. Попробуйте выполнить следующие действия:
- Наложите повязки или бинты.
- Увеличьте потребление витамина C.
- Убедитесь, что вы получаете достаточно витамина A и цинка с пищей.
- Принимайте безрецептурные обезболивающие (ацетаминофен, ибупрофен) только при необходимости.
Лечение прыщей и осветления кожи
Сначала вам нужно определить, вызваны ли прыщи воспалением или нет.
Черные точки и белые точки - это два типа невоспалительных угрей. Их можно обработать салициловой кислотой, чтобы избавиться от лишних мертвых клеток кожи, застрявших в порах.
Воспалительные поражения, такие как узелки, папулы и кисты, могут нуждаться в пероксиде бензоила. Ваш дерматолог может порекомендовать пероральные препараты в более тяжелых случаях.
Если вы хотите осветлить кожу от шрамов и других причин гиперпигментации, рассмотрите следующие варианты:
- альфа-гидроксикислоты, такие как гликолевая кислота
- гидрохинон, отбеливающее средство
- койевая кислота, более натуральный ингредиент
- витамин C
Хотя перекись водорода иногда используется в качестве дезинфицирующего средства для кожи, вы никогда не должны использовать этот продукт без предварительной консультации с врачом. Доказано, что чистые формулы, которые можно купить в аптеке, не эффективны при любых других проблемах и состояниях кожи.
Поговорите со своим дерматологом о других безрецептурных продуктах и профессиональных процедурах, которые вы могли бы использовать для лечения прыщей, гиперпигментации и других проблем, связанных с уходом за кожей.
.Полоскание горла перекисью водорода: применение, преимущества и безопасность
Мы включаем продукты, которые, по нашему мнению, будут полезны нашим читателям. Если вы покупаете по ссылкам на этой странице, мы можем заработать небольшую комиссию. Вот наш процесс.
Перекись водорода - это антисептик, который часто используется для очистки мелких порезов или дезинфекции поверхностей. Из-за своей универсальности перекись водорода является основным продуктом во многих аптечках и аптечках первой помощи, и она легко доступна в большинстве аптек.
Некоторые люди полоскают горло перекисью водорода, чтобы извлечь пользу из ее очищающих свойств.
Жидкость содержит молекулы кислорода и водорода. Это окислитель, а это значит, что он может убивать живые клетки, например бактерии.
Доступны различные концентрации или концентрации перекиси водорода в зависимости от ее предполагаемого использования. Высокие концентрации типичны для промышленного производства. Наиболее распространенная концентрация, продаваемая для домашнего использования, составляет 3 процента.
Каковы потенциальные преимущества полоскания горла перекисью водорода и безопасно ли его использовать? Продолжайте читать, чтобы узнать.
Возможные преимущества полоскания горла перекисью водорода включают:
Отбеливание зубов
Перекись водорода - отбеливающее средство. Фактически, многие виды зубной пасты и жидкости для полоскания рта в магазинах уже содержат это соединение.
В одном исследовании исследователи изучали, могут ли жидкости для полоскания рта с перекисью водорода или 10-процентный гель перекиси карбамида отбеливать зубы более эффективно.
В исследовании участвовали 50 бычьих зубов, окрашенных чаем, и результаты показали, что с течением времени жидкости для полоскания рта с перекисью водорода значительно увеличивали белизну зубов.
Однако они были не так эффективны, как 10-процентный гель перекиси карбамида.
Облегчение боли в горле
Одной из причин боли в горле является бактериальная инфекция. Полоскание горла перекисью водорода может облегчить дискомфорт, уменьшив количество бактерий во рту и помогая избавиться от инфекции.
Перекись водорода может помочь убить бактерии, выделяя кислород, который изменяет среду обитания анаэробных бактерий и подавляет их рост.
Лечение заболеваний десен
Благодаря своим антибактериальным свойствам перекись водорода может помочь в лечении заболеваний десен.
Зубной налет, образующийся на зубах, содержит слизистую пленку бактерий, называемую биопленкой. Перекись водорода выделяет кислород, который помогает уничтожить бактерии.
Рандомизированное исследование 2017 года разделило 53 участника на группы для тестирования перекиси водорода в качестве средства лечения заболеваний десен.
Одна группа получила хирургическую обработку корней и перекись водорода, а другая группа только что получила хирургическую обработку корней.
Результаты показали, что группа перекиси водорода имела значительно меньше признаков заболевания десен к концу исследования по сравнению с группой, которая получала только санацию корней.
Одним из преимуществ полоскания горла раствором перекиси водорода является то, что он может достигнуть задней части рта и мест, до которых трудно добраться с помощью зубной нити.
Уменьшение мелких язв во рту
Полоскание горла перекисью водорода может помочь в лечении незначительных раздражений во рту, таких как порезы или язвы во рту, потому что это антисептик.
При надевании на разрез перекись водорода пузырится или пенится, выделяя кислород. Вспенивание помогает очистить область, удалить мертвые клетки и уменьшить количество бактерий.
Перекиси водорода требуется время, чтобы подействовать. Поскольку полоскание происходит относительно быстро, оно не убивает все бактерии во рту, но может уменьшить их количество.
Поделиться на Pinterest Человек должен полоскать горло около 30 секунд, полоская раствор по всему рту.Важно знать, как правильно использовать раствор перекиси водорода, чтобы получить максимальную пользу и избежать нежелательных побочных эффектов.
Чтобы полоскать горло перекисью водорода:
- Используйте 3-процентную концентрацию перекиси водорода.Что-нибудь более сильное может вызвать раздражение.
- Смешайте две части воды с одной частью перекиси водорода.
- Полоскать горло, полоская раствор вокруг рта.
- Наклоните голову назад и продолжайте полоскание горла в течение 30 секунд.
- Выплюнуть раствор.
Перекись водорода может вызвать вспенивание во рту, что является нормальным явлением.
Чтобы избежать раздражения десен, ограничьте употребление до нескольких раз в неделю.
Перекись водорода безопасна для большинства людей, если они используют ее правильно.Однако соединение может быть вредным, если человек использует его слишком часто или если концентрация слишком высока.
Никогда не полощите горло пищевой перекисью водорода, концентрация которой составляет 35 процентов. Если человек случайно его проглотит, это может привести к серьезным желудочно-кишечным проблемам.
При смешивании раствора избегайте вдыхания перекиси водорода, так как она может вызвать раздражение легких.
Состав также может вызвать раздражение глаз, поэтому, выплевывая раствор, будьте осторожны, чтобы не допустить его обратного разбрызгивания на лицо.
Избегайте проглатывания перекиси водорода. Хотя проглатывание небольшого количества 3-процентной концентрации обычно не вызывает серьезных проблем, это может привести к расстройству желудка и рвоте.
Детям нельзя полоскать горло перекисью водорода, если есть опасность ее проглатывания.
В редких случаях возможны более серьезные побочные эффекты. В этом медицинском отчете 2016 года описывается человек, у которого развился химический колит и гастрит после использования 3-процентной жидкости для полоскания рта перекисью водорода во время стоматологической процедуры.
Если после полоскания горла возникает раздражение, которое не проходит через несколько часов, прекратите использовать для этой цели перекись водорода.
Полоскание горла перекисью водорода может помочь отбелить зубы или уменьшить количество бактерий во рту. Тем не менее, жизненно важно использовать концентрацию не выше 3 процентов и использовать ее в умеренных количествах, чтобы избежать раздражения.
Любой, у кого есть вопросы или опасения по поводу использования перекиси водорода в качестве жидкости для полоскания рта, должен обратиться к стоматологу.
Перекись водорода продается во многих аптеках и в Интернете.
.Почему бы не использовать его
Ожоги - довольно частое явление. Возможно, вы ненадолго прикоснулись к раскаленной плите или утюгу, случайно облили себя кипятком или недостаточно нанесли солнцезащитный крем во время солнечного отпуска.
К счастью, большинство легких ожогов можно легко и успешно вылечить в домашних условиях.
Однако, если вы инстинктивно дойдете до перекиси водорода, вы можете пересмотреть свое решение. Хотя это обычное средство первой помощи во многих домах, перекись водорода может быть не лучшим выбором для лечения ожогов.
Продолжайте читать, чтобы узнать больше о перекиси водорода и лучших способах лечения ожогов.
Загляните под раковину на кухне или в ванной. Скорее всего, у вас там скрывается коричневая бутылка с перекисью водорода.
Обычная бытовая бутылка перекиси водорода, которая также известна своей химической формулой h3O2, в основном состоит из воды. Если на этикетке написано, что это 3-процентный раствор, это означает, что он содержит 3 процента перекиси водорода и 97 процентов воды.
Раствор перекиси водорода используется в качестве местного антисептика не менее века.Люди начали использовать перекись водорода для ухода за ранами в 1920-х годах.
В детстве ваши родители могли даже пролить немного перекиси водорода на ваши ободранные колени. Возможно, вы помните, как пенистые белые пузыри поднимаются по поверхности вашей раны.
Эти пузырьки на самом деле являются действующей химической реакцией. Газообразный кислород образуется, когда перекись водорода вступает в реакцию с ферментом каталазой в клетках кожи.
Наблюдая за появлением пузырьков на ободранном колене, вы могли подумать, что перекись водорода убивает все микробы и помогает вашей поврежденной коже заживать быстрее.
И, как показывает обзор 2019 года, перекись водорода действительно обладает антимикробными свойствами. Он может помочь ослабить и смести мусор и другие материалы, которые могут попасть в рану.
Но, как было отмечено в другом исследовании, «в литературе не было замечено никакого положительного эффекта 3% h3O2 для ускорения заживления». Исследования не подтверждают мнение о том, что ваш надежный флакон с 3-процентной перекисью водорода на самом деле помогает быстрее вылечить ожог или рану.
Хотя на начальном этапе перекись водорода может убить некоторые бактерии, она может вызывать легкое раздражение кожи.Кроме того, это может повредить некоторые клетки кожи и поставить под угрозу процесс образования новых кровеносных сосудов.
И это просто относительно слабый тип перекиси водорода, который вы используете. Более сильные версии могут нанести гораздо более серьезный ущерб.
Лучший выбор: старомодное мягкое мыло и теплая вода. Аккуратно промойте ожог и промокните насухо. Затем нанесите увлажняющий крем и слегка накройте его повязкой.
Легкий ожог - это то, что вы называете поверхностным ожогом. Не выходит за пределы верхнего слоя кожи.Это вызывает некоторую боль и покраснение, но на относительно небольшом участке, возможно, не более 3 дюймов в диаметре.
Если ваш ожог больше или глубже, обратитесь за медицинской помощью.
Вот несколько советов по оказанию первой помощи при легких ожогах:
- Отойдите от источника ожога. Если виновата плита, убедитесь, что она выключена.
- Охладите ожог. Американская академия дерматологии (AAD) рекомендует использовать холодный влажный компресс или погрузить обожженную кожу в прохладную воду примерно на 10 минут.
- Уберите с пути все ограничивающие предметы. Это могут быть украшения, ремни или одежда. Обожженная кожа имеет тенденцию опухать, поэтому поторопитесь.
- Как правило, появляются волдыри, если они у вас есть. Не повреждайте образовавшиеся волдыри. Если волдырь все-таки треснул, аккуратно промойте его водой. Врач может посоветовать нанести на него мазь с антибиотиком.
- Нанесите увлажняющий крем. AAD предлагает вазелин. Другой вариант - нежный увлажняющий лосьон, но избегайте использования сливочного, кокосового масла или зубной пасты, которые часто рекомендуются в качестве домашних средств.
- Накройте ожог. Стерильный кусок марли или бинта с антипригарным покрытием защитит обожженную кожу и позволит ей зажить. Однако убедитесь, что повязка свободна, так как давление может быть болезненным.
- Примите обезболивающее. Безрецептурные обезболивающие, такие как ибупрофен, напроксен или ацетаминофен, могут уменьшить воспаление и обеспечить некоторое облегчение.
Ожог первой степени
Ожог первой степени - это незначительный ожог, поражающий только верхний слой кожи.Вы заметите, что ваша кожа красная и сухая, но у вас вряд ли появятся волдыри.
Обычно ожоги первой степени можно лечить дома или в кабинете врача.
Ожог второй степени
Ожог второй степени можно разделить на два подтипа:
- поверхностный ожог частичной толщины
- глубокий ожог частичной толщины
Поверхностный ожог частичной толщины выходит за пределы верхнего слоя кожи ( эпидермис) в нижний слой, известный как дерма.
Кожа может стать влажной, красной и опухшей, а также могут появиться волдыри. Если надавить на кожу, она может побелеть - это явление называется побледнением.
Глубокий ожог частичной толщины распространяется еще глубже через дерму. Ваша кожа может быть влажной, восковой и сухой. Волдыри встречаются часто. Ваша кожа не станет белой, если вы надавите на нее.
В зависимости от тяжести ожога вам может потребоваться госпитализация, но не обязательно специализированный ожоговый центр.
Ожог третьей степени
Ожоги третьей степени или ожоги полной толщины проникают через дерму вниз в подкожную клетчатку. Ваша кожа может быть белой, серой или обугленной и черной. У тебя не будет волдырей.
Этот вид ожога требует лечения в специализированном ожоговом центре.
Ожог четвертой степени
Это наиболее серьезный вид ожога. Ожог четвертой степени распространяется на эпидермис и дерму и часто поражает мягкие ткани, мышцы и кости под ними.Вам также необходимо будет получить помощь в специализированном ожоговом центре.
Легкий ожог, например ожог первой степени, может не потребовать обращения к врачу. Если вы не уверены, серьезен ли ваш ожог, не повредит обратиться к врачу или поставщику медицинских услуг, чтобы определить, насколько серьезен ваш ожог.
Это также хорошая возможность убедиться, что вы правильно лечите ожог. Ваш врач может посоветовать вам следовать стандартным методам лечения легкого ожога, или вам может потребоваться съездить к врачу или в отделение неотложной помощи, чтобы пройти обследование.
В общем, если размер ожога превышает пару квадратных дюймов, или если вы подозреваете, что ожог выходит за пределы верхнего слоя кожи, вероятно, стоит позвонить.
Кроме того, даже если это небольшой ожог, если боль усиливается или у вас появляются симптомы инфекции, позвоните своему врачу.
Как отмечается в обзоре 2015 года, ваша кожа действует как барьер, и ожог может разрушить этот барьер и сделать вас уязвимыми для инфекции.
Если вы готовите ужин и случайно дотронетесь до горячей сковороды, то, вероятно, можно просто подержать руку под струей прохладной проточной воды, чтобы охладить кожу.
Вы также можете принять безрецептурное обезболивающее, если продолжаете испытывать легкую боль от ожога, но оставьте перекись водорода там, где вы ее нашли.
Но не игнорируйте более крупный или глубокий ожог. Эти более серьезные ожоги требуют более серьезного подхода. В случае сомнений обратитесь к медицинскому эксперту.
.Новое устройство производит перекись водорода для очистки воды
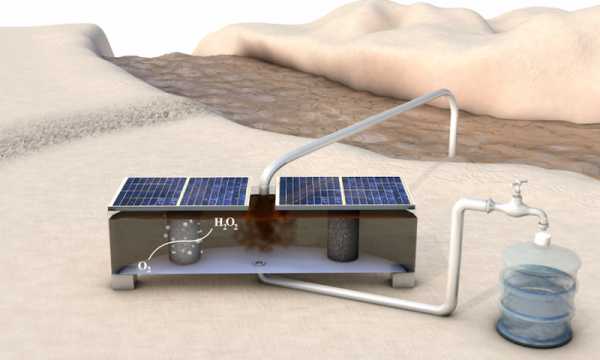 Схематическое изображение местной системы очистки воды для сельских общин. Недорогое портативное устройство, работающее на солнечных батареях, производит перекись водорода из газообразного кислорода и воды. Предоставлено: Чжихуа Чен / Стэнфордский университет.
Схематическое изображение местной системы очистки воды для сельских общин. Недорогое портативное устройство, работающее на солнечных батареях, производит перекись водорода из газообразного кислорода и воды. Предоставлено: Чжихуа Чен / Стэнфордский университет. Ограниченный доступ к чистой воде - серьезная проблема для миллиардов людей в развивающихся странах, где источники воды часто загрязнены городскими, промышленными и сельскохозяйственными отходами.Многие болезнетворные организмы и органические загрязнители можно быстро удалить из воды с помощью перекиси водорода, не оставляя никаких вредных остаточных химических веществ. Однако производство и распространение перекиси водорода представляет собой проблему во многих частях мира.
Теперь ученые из Национальной ускорительной лаборатории SLAC Министерства энергетики и Стэнфордского университета создали небольшое устройство для производства перекиси водорода, которое может работать от возобновляемых источников энергии, таких как обычные солнечные батареи.
«Идея состоит в том, чтобы разработать электрохимический элемент, который вырабатывает перекись водорода из кислорода и воды на месте, а затем использовать эту перекись водорода в грунтовых водах для окисления органических загрязнителей, вредных для организма человека», - сказал Крис Хан, сотрудник SLAC. ученый.
Их результаты были опубликованы 1 марта в журнале Reaction Chemistry and Engineering .
Проект был результатом сотрудничества трех исследовательских групп из Центра изучения взаимодействия и катализа SUNCAT, которым совместно руководят SLAC и Стэнфордский университет.
«Большинство проектов здесь, в SUNCAT, следуют аналогичному пути, - сказал Чжихуа (Билл) Чен, аспирант в группе Тома Джарамилло, доцента SLAC и Стэнфорда. «Они начинают с предсказаний, основанных на теории, переходят к разработке катализаторов и в конечном итоге создают прототип устройства с практическим применением».
 В этом портативном недорогом устройстве, размер которого умещается в одной руке, используется газообразный кислород и вода для производства перекиси водорода, которую можно использовать для очистки воды в сельских районах.Предоставлено: Чжихуа Чен / Стэнфордский университет.
В этом портативном недорогом устройстве, размер которого умещается в одной руке, используется газообразный кислород и вода для производства перекиси водорода, которую можно использовать для очистки воды в сельских районах.Предоставлено: Чжихуа Чен / Стэнфордский университет. В данном случае исследователи из теоретической группы во главе с профессором SLAC / Стэнфорда Йенсом Норсковым использовали компьютерное моделирование в атомном масштабе для исследования катализаторов на основе углерода, способных снизить стоимость и повысить эффективность производства пероксида водорода. Их исследование показало, что большинство дефектов в этих материалах естественным образом селективны к образованию перекиси водорода, а некоторые также очень активны. Поскольку дефекты могут образовываться естественным образом в углеродных материалах в процессе роста, ключевым моментом было создание материала с максимально возможным количеством дефектов.
«В моем предыдущем катализаторе этой реакции использовалась платина, которая слишком дорога для децентрализованной очистки воды», - сказала инженер-исследователь Самира Сиахростами. «Самое прекрасное в нашем более дешевом углеродном материале - это то, что он имеет огромное количество дефектов, которые являются активными центрами для катализирования образования перекиси водорода».
Аспирант Стэнфорда Шученг Чен, который работает с профессором Стэнфорда Чжэнаном Бао, затем приготовил углеродные катализаторы и измерил их свойства.С помощью штатных ученых SSRL Денниса Нордлунда и Димостениса Сокараса эти катализаторы также были охарактеризованы с помощью рентгеновских лучей в Стэнфордском источнике синхротронного излучения SLAC, являющемся объектом научных исследований Министерства энергетики США.
«Мы полагались на наши эксперименты в SSRL, чтобы лучше понять структуру нашего материала и проверить, есть ли в нем нужные дефекты», - сказал Шученг Чен.
Наконец, он передал катализатор своему соседу по комнате Биллу Чену, который спроектировал, построил и протестировал их устройство.
«В нашем устройстве три отсека, - пояснил Билл Чен. «В первой камере газообразный кислород проходит через камеру, взаимодействует с катализатором, изготовленным Shucheng, и восстанавливается до перекиси водорода. Затем перекись водорода поступает в среднюю камеру, где хранится в растворе». В третьей камере другой катализатор превращает воду в газообразный кислород, и цикл начинается заново.
Разделение двух катализаторов средней камерой делает устройство дешевле, проще и надежнее, чем их разделение с помощью стандартной полупроницаемой мембраны, которая может разрушаться и разрушаться перекисью водорода.
 Небольшое устройство для производства перекиси водорода (металлический ящик на фото справа), которое питается от двух обычных солнечных батарей. Недорогое устройство разрабатывается для производства перекиси водорода на месте для очистки воды в сельской местности. Предоставлено: Чжихуа Чен / Стэнфордский университет.
Небольшое устройство для производства перекиси водорода (металлический ящик на фото справа), которое питается от двух обычных солнечных батарей. Недорогое устройство разрабатывается для производства перекиси водорода на месте для очистки воды в сельской местности. Предоставлено: Чжихуа Чен / Стэнфордский университет. Устройство также может работать на возобновляемых источниках энергии, доступных в деревнях. Электрохимический элемент представляет собой электрическую цепь, которая работает с небольшим напряжением, приложенным к ней.Реакция в первой камере помещает электроны в кислород для образования перекиси водорода, которая уравновешивается встречной реакцией в третьей камере, которая отбирает электроны из воды для образования кислорода, согласовывая ток и замыкая цепь. Поскольку устройству требуется всего 1,7 вольт между катализаторами, оно может работать от батареи или двух стандартных солнечных батарей.
Исследовательские группы сейчас работают над устройством большей емкости.
В настоящее время средняя камера содержит только около 10 микролитров перекиси водорода; они хотят сделать его больше.Они также пытаются непрерывно циркулировать жидкость в средней камере, чтобы быстро откачать перекись водорода, поэтому размер камеры хранения больше не ограничивает производство.
Они также хотели бы производить перекись водорода в более высоких концентрациях. Однако для обработки одного литра воды требуется всего несколько миллиграммов, а текущий прототип уже обеспечивает достаточную концентрацию, которая составляет одну десятую концентрации перекиси водорода, которую вы покупаете в магазине для своих основных медицинских нужд.
В долгосрочной перспективе команда хочет изменить щелочную среду внутри клетки на нейтральную, которая больше похожа на воду. Это упростило бы использование людьми, потому что перекись водорода можно было смешивать с питьевой водой напрямую, без необходимости ее предварительной нейтрализации.
Члены команды рады своим результатам и чувствуют, что они на правильном пути к разработке практического устройства.
«В настоящее время это всего лишь прототип, но я лично думаю, что он будет блестящим в области децентрализованной очистки воды для развивающихся стран», - сказал Билл Чен.«Это похоже на волшебный ящик. Надеюсь, это станет реальностью».
Управление спином электронов делает расщепление воды более эффективным
Дополнительная информация: Чжихуа Чен и др. Разработка реактора с углеродными катализаторами для модульного недорогого электрохимического производства HO, React.Chem. Англ. (2017). DOI: 10.1039 / C6RE00195E Предоставлено Национальная ускорительная лаборатория SLAC
Ссылка : Новое устройство производит перекись водорода для очистки воды (2017, 3 апреля) получено 8 декабря 2020 с https: // физ.org / news / 2017-04-device-water-peroxide-purification.html
Этот документ защищен авторским правом. За исключением честных сделок с целью частного изучения или исследования, нет часть может быть воспроизведена без письменного разрешения. Контент предоставляется только в информационных целях.
.